Хлорид ниобия(V)
| Хлорид ниобия(V) | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид ниобия(V), пентахлорид ниобия | ||
| Хим. формула | NbCl5 | ||
| Физические свойства | |||
| Состояние | Желтые игольчатые кристаллы | ||
| Молярная масса | 270.17 г/моль | ||
| Плотность | 2,75 г/см³ | ||
| Энергия ионизации | 10,97 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 204.7 °C | ||
| • кипения | 254[1] °C | ||
| • вспышки | негорюч °C | ||
| Энтальпия | |||
| • образования | -797.47 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | разлагается | ||
| • в остальных веществах | растворим в | ||
| Структура | |||
| Кристаллическая структура | Тригональная бипирамидальная | ||
| Классификация | |||
| Рег. номер CAS | 10026-12-7 | ||
| PubChem | 24818 и 10199297 | ||
Рег. номер EINECS |
233-059-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | QU0350000 | ||
| ChemSpider | 23203 и 8374796 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорид ниобия(V) (пентахлорид ниобия) — это
Структура и свойства
Хлорид ниобия(V) гигроскопичен, легко гидролизуется.
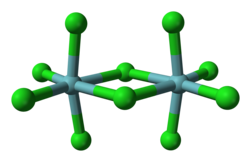
В твердом состоянии пентахлорид ниобия является димером с «мостиковыми» атомами хлора (см. изображение), то есть реальная молекула имеет формулу Nb2Cl10. Каждый ниобий окружен шестью ионами хлора, но октаэдрическая координация существенно искажена (см. структурное изображение).
Длины экваториальных связей Nb—Cl равны 0,225 нм (терминальная) и 0,256 нм (мостиковая), соответственно. Длина внеплоскостной связи ниобий—хлор равна 0,2292 нм и она образует с экваториальной плоскостью молекулы
Получение
Ниобия пентахлорид получается прямым
Также получают нагреванием смеси Nb2O5 с углем в токе хлора:
Может быть получен путём хлорирования
Пентахлорид ниобия может быть очищен от примесей, оставшихся после реакций с помощью сублимации. Может быть получен хлорированием ниобия, ферросплавов ниобия, а также танталит-колумбитового сырья.[3]
Использование

Соединение используется в органической химии как
Пентахлорид ниобия используется в качестве исходного материала в химическом производстве для получения чистого ниобия.
Примечания
- ↑ Важнейшие соединения ниобия. Дата обращения: 3 апреля 2010. Архивировано из оригинала 3 мая 2006 года.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Патенты Российской Федерации (недоступная ссылка — история). Дата обращения: 3 апреля 2010.