Нуклеофил
Нуклеофил в химии (лат. nucleus «ядро», др.-греч. φιλέω «любить») — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь[1]. Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой.
Нуклеофил — электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями (электрофилами). Примерами нуклеофилов являются анионы (Cl−, Br−, I−) и соединения с неподелённой электронной парой (NH3, H2O).
В ходе реакций
Амбидентные нуклеофилы имеют два и более реакционных центра. К примеру,
Термины «нуклеофил» и «электрофил» были введены в 1929 Кристофером Ингольдом[3], заменив предложенные ранее (в 1925) Лэпворсом «катионоид» и «анионоид»[4].
Примеры
В показанном ниже примере
В данной реакции атака нуклеофила происходит со стороны, противоположной уходящей группе. Вследствие этого SN2-процессы сопровождаются обращением (инверсией) конфигурации.
Классификация
Нуклеофилы можно классифицировать несколькими способами: по типу орбитали, с которой донируются электроны, и по природе атома, который образует связь.
По типу реагирующей орбитали
В зависимости от природы орбитали, на которой располагались электроны, пошедшие на образование связи с электрофилом, можно выделить:
- π-нуклеофилы (электроны ушли с π-орбитали):
- алкены, диены, алкины;
- аллилсиланы, аллилгерманы, аллилстаннаны;
- алкил- и силиленоловые эфиры;
- ароматические соединения;
- n-нуклеофилы (электроны находились на несвязывающей орбитали — неподелённой электронной паре):
- σ-нуклеофилы (электроны ушли с σ-орбитали):
- доноры гидрид-иона H−.
По атому, образующему связь
Углеродные нуклеофилы
Нуклеофилами с реакционным центром на атоме углерода являются:
- алкил- и арилметаллогалиды (например, CH3MgBr, PhMgCl и т. д.) в реакциях Гриньяра, Реформатского, Барбье и др.
- органолитиевые реагенты (PhLi) и анионы терминальных алкинов (HC≡C−Li+);
- конденсации Кляйзена.
- другие частицы с полным или частичным отрицательным зарядом на атоме углерода (например, −CH2−NO2).
Азотные нуклеофилы
Примерами азотных нуклеофилов являются аммиак (NH3), органические амины (RNH2, R2NH, R3N) и азиды (R−N3).
Кислородные нуклеофилы
Типичными кислородными нуклеофилами являются
Серные нуклеофилы
Серосодержащие соединения обычно являются хорошими нуклеофилами, так как атом
Шкалы нуклеофильности
Известно несколько способов количественного описания реакционной способности нуклеофилов. Приведенные ниже методы основаны на изучении экспериментальных данных о скорости определенных реакций с участием большого количества нуклеофилов и электрофилов. Как правило, реагенты с выраженным альфа-эффектом не включаются в эти корреляции.
Уравнение Свена — Скотта
Уравнение Свена — Скотта было выведено в 1953 году и является первой попыткой количественно описать реакционную способность нуклеофилов в реакциях SN2[5][6]:
В этом уравнении k —
Таким образом, для реакций
- CH3I + H2O → CH3OH + HI
- CH3I + Nuc−H → CH3−Nuc + HI
уравнение Свена — Скотта можно записать как
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| SO32− | 5,16 | CN− | 5,10 | I− | 5,04 |
| SCN− | 4,77 | HO− | 4,20 | N3− | 4,00 |
| Br− | 3,89 | HCO3− | 3,80 | Cl− | 3,04 |
| CH3COO− | 2,72 | SO42− | 2,50 | F− | 2,00 |
| NO3− | 1,03 | CH3OH | 0,70 | H2O | 0,00 |
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| F− | 2,7 | Cl− | 4,37 | Br− | 5,79 |
| I− | 7,42 | N3− | 5,78 | NC− | 6,70 |
| CH3OH | ~0,00 | H2O | 0,00 | CH3CO2− | 4,3 |
| PhO− | 5,75 | CH3O− | 6,29 | Пиридин | 5,23 |
| Анилин | 5,70 | Триэтиламин | 6,66 | PhSH | 5,7 |
Уравнение Ричи
Уравнение Ричи было выведено в 1972 году [9] и выражается следующим образом[10]:
- ,
где — константа скорости реакции стандартного катиона (обычно соли диазония) с со стандартным нуклеофилом (водой) в водной среде, — константа скорости реакции с заданным нуклеофилом, — параметр, зависящий от нуклеофила (табл. 3):
| Нуклеофил (растворитель) |
Значение N+ | Нуклеофил (растворитель) |
Значение N+ |
|---|---|---|---|
| H2O (H2O) | 0,0 | MeOH (MeOH) | 0,5 |
| CN− (H2O) | 3,8 | CN− (MeOH) | 5,9 |
| HO− (H2O) | 4,5 | MeO− (MeOH) | 7,5 |
| N3− (H2O) | 5,4 | N3− (MeOH) | 8,5 |
| PhS− ( ДМСО )
|
13,1 | PhS− (MeOH) | 10,7 |
Важной особенностью уравнения Ричи является отсутствие параметра чувствительности субстрата (σ в уравнении Свена-Скотта). Таким образом, принимается, что относительная реакционная способность двух нуклеофилов определяется только значением N+ и не зависит от партнера по реакции. Это находится в резком противоречии с т. н. принципом взаимозависимости реакционной способности и селективности[11]. Из-за этого уравнение Ричи иногда называется «соотношение постоянной селективности»[12]. Явная упрощенность вызвала ряд публикаций о пределах его применимости[12][13].
Уравнение Майра — Патца
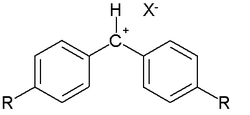
В
В этом уравнении
Диарилметильные катионы были выбраны в качестве стандартных электрофилов потому, что их активностью можно управлять подбором заместителя R в пара-положении. Таким образом, оказалось возможным измерить реакционную способность очень разных нуклеофилов. Для протестированных соединений параметр N изменяется в диапазоне от −4,47 до 28,95 (Табл. 4)[15].

| Нуклеофил | N (s) | Нуклеофил | N (s) |
|---|---|---|---|
| 1 | −4,47 (1,32) | 2 | −0,41 (1,12) |
| 3 | +0,96 (1) | 4 | −0,13 (1,21) |
| 5 | +3,61 (1,11) | 6 | +7,48 (0,89) |
| 7 | +13,36 (0,81) | PhC−(CN)CH3[16] | 28,95 (0,58) |
Параметр элекрофильности E для некоторых карбокатионов можно грубо оценить по следующему уравнению[14]:
- ,
где kw — константа псевдопервого порядка для реакции карбокатиона с водой при 20 °C.
Нуклеофильность N в уравнении Майра — Патца связана с параметром Ричи N+ следующим соотношением:
Объединенное уравнение
В попытке объединить все вышеописанные уравнения Майр с сотрудниками предложили следующее выражение[17]:
,
где sE — параметр чувствительности электрофила; sN — параметр чувствительности нуклеофила; N и E имеют такое же значение, как и в уравнении Майра — Патца.
С помощью соответствующих подстановок данное выражение можно превратить в любое описанное ранее уравнение:
- при sE = 1 (для карбокатионов) это уравнение эквивалентно оригинальному уравнению Майра — Патца;
- при sN = 0.6 (для большинства n-нуклеофилов):
- ,
- что эквивалентно уравнению Свена-Скотта:
- ;
- при sE = 1 и sN = 0.6 получим:
- что эквивалентно уравнению Ричи в немного измененном виде:
См. также
Примечания
- ↑ 1 2 Кери Ф., Сандберг Р. Углубленный курс органической химии: Пер. с англ. = Advanced Organic Chemistry / Под ред. В. М. Потапова. — М.: Химия, 1981. — Т. 1. Структура и механизмы. — 520 с.
- ↑ Ingold, C. K. // Recl. Trav. Chim. Pays-Bas. — 1929.
- ↑ Lapworth, A. // Nature. — 1925. — Vol. 115. — P. 625.
- ↑ C. Gardner Swain, Carleton B. Scott. Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides (англ.) // J. Am. Chem. Soc.. — 1953. — Vol. 75. — P. 141-147. Архивировано 5 августа 2020 года.
- ↑ Swain–Scott equation (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (7 сентября 2009). Дата обращения: 22 августа 2010. Архивировано 7 мая 2012 года.
- ↑ Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑ R. G. Pearson, H. Sobel, J. Songstad. Nucleophilic reactivity constants toward methyl iodide and trans-[Pt(py)2Cl2] (англ.) // J. Am. Chem. Soc.. — 1968. — Vol. 90. — P. 319-326.
- ↑ 22 июня 2023 года.
- doi:10.1351/goldbook.R05402. Дата обращения: 22 августа 2010. Архивировано7 мая 2012 года.
- ↑ «Чем более активен реагент, тем он менее селективен.»
- ↑ .
- .
- ↑ 23 декабря 2010 года.
- ↑ 1 2 H. Mayr et al. Mayr's Database of Reactivity Parameters (англ.). Дата обращения: 2 сентября 2010. Архивировано 7 мая 2012 года.
- ДМСО.
- 19 ноября 2015 года.



















