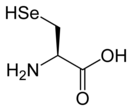
Селеноцистеин
| Селеноцистеин | |||
|---|---|---|---|
| |||
| Общие | |||
| Сокращения | Sec | ||
| Хим. формула | C3H7NO2Se | ||
| Физические свойства | |||
| Молярная масса | 168.053 г/моль г/моль | ||
| Классификация | |||
| Рег. номер CAS | 10236-58-5 | ||
| PubChem | 25076 и 163189568 | ||
Рег. номер EINECS |
808-428-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16633 и 57843 | ||
| ChemSpider | 23436 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Селеноцистеи́н (сокращённо Sec или U, в старых публикациях также Se-Cys
Селеноцистеин впервые был обнаружен в бактериях клостридиях в 1972 году биохимиком Треcой Штадтман[англ.] (англ. Thressa Stadtman) из Национального института сердца, легких и крови США (Национальные институты здравоохранения США)[3]. Позже она с коллегами показала важную роль селеноцистеина в формировании многих других ферментов и его участие в метаболизме человека.
Структура
Структура селеноцистеина сходна с таковой цистеина с тем лишь отличием, что в нём атом серы заменён на атом селена, образуя
Биология
Селеноцистеин имеет более низкую, чем у цистеина,
В отличие от других аминокислот, встречающихся в белках, селеноцистеин не имеет своего особого
Другое отличие селеноцистеина от стандартных аминокислот заключается в том, что он не существует в свободном виде внутри клетки, так как его высокая реакционная активность может нанести вред клетке. Вместо этого клетка хранит селен в форме менее активного
У человека известно 25 селенопротеинов[10].
Производные селеноцистеина γ-глутамил-Se-метилселеноцистеин и Se-метилселеноцистеин в природе известны у
Применение
Биотехнологическое применение селеноцистеина включает использование Sec, меченного
См. также
- Пирролизин, другая нестандартная аминокислота.
- Селенометионин, другая селеносодержащая аминокислота, случайно заменяющая метионин.
- Селенопротеины
Примечания
- 19 февраля 2018 года.
- ↑ .
- .
- .
- .
- .
- .
- ↑ Atkins, J. F. Recoding: Expansion of Decoding Rules Enriches Gene Expression (англ.). — Springer, 2009. — P. 31. — ISBN 9780387893815. Архивировано 6 декабря 2014 года.
- ↑ Berry, M. J.; Banu, L.; Harney, J. W.; Larsen, P. R. Functional Characterization of the Eukaryotic SECIS Elements which Direct Selenocysteine Insertion at UGA Codons (англ.) // The EMBO Journal[англ.] : journal. — 1993. — Vol. 12, no. 8. — P. 3315—3322. — PMID 8344267. — PMC 413599. Архивировано 20 сентября 2018 года.
- .
- ↑ Block, E. Garlic and Other Alliums: The Lore and the Science (англ.). — Royal Society of Chemistry, 2010. — ISBN 0-85404-190-7.
Литература
- Lobanov A. V., Hatfield D. L., Gladyshev V. N. Eukaryotic selenoproteins and selenoproteomes // Biochimica et Biophysica Acta. — 2009. — Vol. 1790, № 11. — P. 1424—1428. — .
- Turanov A. A., Shpikalova M. A., Lobanov A. V., Fomenko D. E., Morrison H. G., Sogin M. L., Klobutcher L. A., Hatfield D. L., Gladyshev V. N. Genetic code supports targeted insertion of two amino acids by one codon (англ.) // .
- Zinoni F., Birkmann A., Leinfelder W., Bock A. Cotranslational insertion of selenocysteine into formate dehydrogenase from Escherichia coli directed by a UGA codon (англ.) // .
Ссылки
- Одноклеточное поставило под сомнение одну из основных догм генетики. Лента.ру, 11 января 2009 г. (Дата обращения: 29 июля 2011)
- Пётр Баранов. Кодон в двух лицах. Газета.ру, 12 января 2009 г. (Дата обращения: 29 июля 2011)
- Александр Марков. Генетический код допускает разночтения. Элементы, 14 января 2009 г. (Дата обращения: 29 июля 2011)