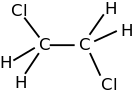
1,2-Дихлорэтан
| 1,2-Дихлорэтан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1,2-дихлорэтан | ||
| Хим. формула | C2H4Cl2 | ||
| Рац. формула | ClCH2CH2Cl | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 98,96 г/моль | ||
| Плотность | 1,254 (при 20 °C) | ||
| Энергия ионизации | 11,05 ± 0,01 эВ[1] и 11,04 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −35,36 °C | ||
| • кипения | 83,47 °C | ||
| • вспышки | 56 ± 1 ℉[1] | ||
Пределы взрываемости |
6,2 ± 0,1 об.%[1] | ||
| Энтальпия | |||
| • образования | −166,8 кДж/моль | ||
Удельная теплота испарения |
32,024 Дж/кг | ||
| Удельная теплота плавления | 8,837 Дж/кг | ||
| Давление пара | 64 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,87 г/100 мл | ||
| • в этаноле | растворим | ||
| • в ацетоне | растворим | ||
| • в бензоле | растворим | ||
| • в CCl4 | растворим | ||
| Структура | |||
| Дипольный момент | 1,80 Д | ||
| Классификация | |||
| Рег. номер CAS | 107-06-2 | ||
| PubChem | 11 | ||
Рег. номер EINECS |
203-458-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI0525000 | ||
| ChEBI | 27789 | ||
| ChemSpider | 13837650 | ||
| Безопасность | |||
| Токсичность | токсично | ||
| Фразы риска (R) | R10, R16, R18, R33, R36/37/38, R39/26/28, R44, R45, R46, R48/21, R51/53, R55, R56, R57, R67 | ||
| Фразы безопасности (S) | S53, S45 | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
1,2-Дихло́рэта́н (преж. хлористый этилен) — хлорорганическое вещество; бесцветная жидкость со сладковатым запахом, имеющая
История создания
В 1781 году
Физические свойства
1,2-Дихлорэтан представляет собой бесцветную летучую жидкость со сладковатым запахом, напоминающим хлороформ. Хорошо растворяется в спирте, эфире, нефтяных углеводородах, плохо растворим в воде. Плотность при 20 °C составляет 1,253 г/см3. Температура кипения составляет 83,47 °C, а плавления — −35,36 °C. Легко испаряется, образует азеотропную смесь с водой (71,6 °C, 91,8 масс. % дихлорэтана)[7]. Является хорошим растворителем многих органических соединений и полимеров, при этом твердые углеводороды при температуре ниже 25 °C растворяются в дихлорэтане плохо, на этом основано его применение для депарафинизации масел[8].
Химические свойства
1,2-Дихлорэтан вступает в реакции галогенирования, например, взаимодействует с хлором в жидкой или газовой фазе в присутствии радикальных инициаторов, образуя 1,1,2-трихлорэтан[7]:
Подвергается дегидрохлорированию под действием спиртовых или водных растворов щелочей или при нагревании выше 250 °C с образованием винилхлорида[7]:
Вступает в реакцию гидролиза с образованием этиленгликоля. Реакция протекает в присутствии кислот или щелочей при 140—250 °C и давлении до 4 МПа[7]:
При нагревании до 120 °C дихлорэтана с аммиаком в водных или спиртовых средах в присутствии солей аммония получают этилендиамин[7]:
С цианистым натрием дихлорэтан образует сукциннитрил[7]:
Вступает в реакцию алкилирования в присутствии катализаторов Фриделя-Крафтса, взаимодействуя с бензолом и его аналогами[7]:
При нагревании с растворами полисульфидов натрия дихлорэтан образует каучукоподобное вещество тиокол[7]:
Получение
В США, Западной Европе и Японии суммарно производится более 17,5 млн тонн в год 1,2-дихлорэтана[9].
Основным методом получения является катализируемая хлоридом железа (III) реакция присоединения хлора к этилену. Данная реакция протекает в две стадии при температуре 20—80 °С в среде дихлорэтана. На выходе получают продукт чистотой 99,86 % (масс.), селективность процесса повышают до 98,5 % и выше добавками ингибитора[10].
В 1979 году был предложен другой способ проведения данной реакции, заключающийся в том, что хлорирование этилена ведут при температуре 95—130 °С под небольшим давлением в присутствии хлоридов меди и сурьмы в качестве катализаторов, применяя 1—10 % избыток этилена[10].
Другим распространённым способом получения 1,2-дихлорэтана является окислительное хлорирование этилена в присутствии катализатора на основе хлорида меди (II). Степень конверсии этилена составляет 20—40 %[10].
Применение
Наиболее широко 1,2-дихлорэтан применяют в качестве полупродукта для получения винилхлорида (реакция описана выше), а также этиленгликоля, тиокола и других веществ[6].
Как растворитель 1,2-дихлорэтан обладает многими преимуществами, такими как дешевизна, большая растворяющая способность, слабая относительно многих других растворителей воспламеняемость и лёгкость крупнотоннажного получения. Однако ввиду склонности к гидролизу при кипячении с водой с образованием агрессивной солянокислой среды, чаще применяют более дорогой трихлорэтилен[6]. Также хлористый этилен не растворяет нитро- и ацетилцеллюлозу (только в смеси с метанолом или этанолом). Другой причиной, ограничивающей широкое применения дихлорэтана, является его токсичность[11].
1,2-Дихлорэтан применяют в качестве экстрагирующего агента в производстве
Зачастую применяется как клей для склеивания изделий из оргстекла и поликарбоната и приготовления жидких клеевых составов на их основе.
Применяется для повышения активности катализатора риформинга бензинов[13].
Безопасность
1,2-Дихлорэтан — сильное наркотическое средство, канцероген
Максимальная из разовых массовых концентраций примеси в
Примечания
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0271.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Химическая энциклопедия, 1990, Т. 2. Дихлорэтан, с. 106.
- ↑ Дебу, 1891.
- ↑ Ю.С. Мусабеков. История органического синтеза в России. — М.: Изд-во АН СССР, 1958. — С. 69. — 287 с.
- ↑ 1 2 3 С.И. Вольфкович. Общая химическая технология. — М.: Госхимиздат, 1959. — Т. 2. — С. 406. — 846 с.
- ↑ 1 2 3 4 5 6 7 8 Л. А. Ошин. Промышленные хлорорганические продукты. — М.: Химия, 1978. — С. 100—110. — 656 с.
- ↑ 1 2 В. Л. Гурвич. Избирательные растворители в переработке нефти. — М.: Гостоптехиздат, 1953. — С. 249. — 321 с.
- .
- ↑ 1 2 3 Ф. Ф. Муганлинский, Ю. А. Трегер, М. М. Люшин. Химия и технология галогенорганических соединений. — М.: Химия, 1991. — С. 91—95. — 272 с. — ISBN 5-7245-0540-1.
- ↑ 1 2 К. Элисс. Химия углеводородов нефти и их производных. — М.: ОНТИ: Глав. ред. хим. лит-ры, 1936—1938. — С. 511—514. — 634 с.
- ↑ Д. Д. Зыков. Общая химическая технология органических веществ. — М.: Химия, 1966. — С. 184. — 608 с.
- ↑ Курмангазиева Л. Т., Оразбаев Б. Б. Разработка математических моделей и оптимизация химико-технологических систем при нечеткости исходной информации. Дата обращения: 4 декабря 2020. Архивировано 26 сентября 2020 года.
- ↑ Показатели на основе биомониторинга экспозиции к химическим загрязнителям. Дата обращения: 1 октября 2016. Архивировано 22 декабря 2018 года.
- ↑ 1 2 ГОСТ 1942-86. 1,2-Дихлорэтан технический. Технические условия. Дата обращения: 1 октября 2016. Архивировано 27 сентября 2016 года.
- МКХБ Международная организация труда. МКХБ № 0250. 1,2-Дихлорэтан. www.ilo.org/dyn/icsc/ (2018). Дата обращения: 27 декабря 2019. Архивировано14 августа 2020 года.
- Советская энциклопедия, 1977. — Т. 7 : Дегидразы — Дядьковский. — С. 419—420. — 548 с. : ил.
- ↑ Лужников Е. А., Муромов А. Л. Отравление суррогатами алкоголя // Здоровье : журнал. — 1974. — № 12 (240). — С. 29.
- ↑ (Роспотребнадзор). № 980. 1,2-Дихлорэтан // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 72. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ISSN 0039-0771.
- .
Литература
- Химическая энциклопедия / под ред. И. Л. Кнунянца — М.: Советская энциклопедия, 1990. — Т. 2 : Даф-Мед. — 671 с. — ISBN 5-82270-035-5
- Дебу К. Этилен хлористый // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1891. — Т. IIa. — С. 912—913.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |