Занамивир
Для улучшения этой статьи по фармакологии желательно: |
| Занамивир | |
|---|---|
| Zanamivir | |
 | |
| Химическое соединение | |
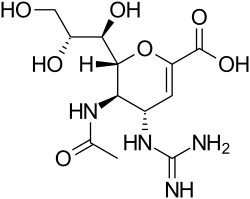
| ИЮПАК | (2R,3R,4S)- 4-[(diaminomethylidene)amino]- 3-acetamido- 2-[(1R,2R)- 1,2,3-trihydroxypropyl]- 3,4-dihydro- 2H-pyran- 6-carboxylic acid |
| Брутто-формула | C12H20N4O7 |
| Молярная масса | 332.31 г/моль |
| CAS | 139110-80-8 |
| PubChem | 60855 |
| DrugBank | APRD00378 |
| Состав | |
| Классификация | |
| АТХ | J05AH01 |
| МКБ-10 | J10 |
| Фармакокинетика | |
| Биодоступн. | 2% (орально) |
| Связывание с белками плазмы | <10% |
Метаболизм |
Не метаболизируется |
| Период полувывед. | 2 - 3 часа (при нормальной функции почек), примерно 12 - 20 часов (при тяжелой почечной недостаточности) |
Экскреция |
с мочой |
| Лекарственные формы | |
| порошок для ингаляций дозированный | |
| Способы введения | |
| Ингаляционно (устройство "Дискхалер") | |
| Другие названия | |
| Реленза | |
Занамивир (Zanamivir) — противовирусный препарат, используемое для лечения и профилактики гриппа, вызванного вирусами гриппа A и B.
Разработан австралийской биотехнологической фирмой Biota Holdings. Лицензирован Glaxo в
Методами доказательной медицины клиническая эффективность занамивира не доказана[3]. Выпускается под торговой маркой «Реленза».
История
Занамивир был впервые произведен в 1989 году учеными под руководством Питера Колмана[4][5] и Джозефа Варгезе[6] из австралийского Государственного объединения научных и прикладных исследований (CSIRO) в сотрудничестве с Викторианским фармацевтическим колледжем и Университетом Монаша. Занамивир был первым из ингибиторов нейраминидазы. Открытие было первоначально профинансировано австралийской биотехнологической компанией Biota и было частью продолжающейся программы Biota по разработке противовирусных агентов посредством рационального конструирования лекарств[7].
Медицинское использование
Занамивир используется для лечения инфекций, вызванных вирусами гриппа A и B, но для здоровых людей польза от нее в целом невелика. Это снижает риск развития симптоматического, но не бессимптомного гриппа. Сочетание диагностической неопределенности, риска устойчивости к штамму вируса, возможных побочных эффектов и финансовых затрат перевешивает небольшие преимущества занамивира для профилактики и лечения здоровых людей[8].
По состоянию на
Фармакологическое действие
Занамивир —
Фармакокинетика
После ингаляции всасывается 10-20 % введенной дозы, концентрация в
Показания
Грипп типа А и В у взрослых и детей старше 5 лет (лечение и профилактика).
Противопоказания
Гиперчувствительность, беременность (I триместр), период лактации, детский возраст (до 5 лет).
Занамивир относится к «
Побочные эффекты
- Со стороны дыхательной системы: бронхоспазм[13], затруднение дыхания — очень редко.
- Со стороны кожных покровов: сыпь, крапивница — очень редко.
- Аллергические реакции: отек лица, гортани — очень редко.
В
Механизм действия
Биодоступность занамивира составляет 2%. После ингаляции занамивир концентрируется в легких и глотке, где до 15% дозы абсорбируется и выводится с мочой[17].
Режим дозирования
Ингаляционно.
- Лечение
2 ингаляции 2 раза в сутки в течение 5 дней. Общая суточная доза — 20 мг.
Для достижения оптимального эффекта лечение должно быть начато при появлении первых симптомов заболевания в течение первых 48 часов. Пациенты с заболеваниями дыхательных путей должны иметь в качестве средства скорой помощи короткодействующие
- Профилактика
2 ингаляции 1 раз в сутки в течение 10 дней. Общая суточная доза — 10 мг. Длительность приема может быть увеличена до 1 мес, если риск инфицирования сохраняется более 10 дней.
- Взаимодействие
Не комбинировать с другими ингаляционными препаратами (в том числе бронходилататорами).
Эффективность
Эффективность занамивира достоверно не доказана[3].
По данным исследований, использованных производителями при сертификации ингибиторов нейраминидазы в разных странах, выявлено недостаточное качество исследований — они имеют проблемы в дизайне и эти проблемы препятствуют любому определённому заключению. Анализ этих исследований (26 исследований по занамивиру и 20 по осельтамивиру) показал[3]:
- при лечении гриппоподобного заболевания (неподтвержденный грипп) выявлено сокращение продолжительности симптомов менее, чем на один день;
- клинические испытания по профилактике гриппа показали снижение риска симптомов гриппа у отдельных лиц и в семье;
- не было доказательств влияния на бессимптомный грипп или на гриппоподобные заболевания;
- информация о влиянии на осложнения гриппа была ненадёжной;
- у детей с астмой не было ясного влияния на сокращение времени до облегчения симптомов.
- заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими даннымиВывод исследователей обзора: «Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.»
В 2011 году были выявлены штаммы вируса гриппа A, устойчивые к занамивиру, в том числе у людей, не лечившихся этим препаратом[18].
Мнения контролирующих органов
Роспотребнадзор: вирус «свиного» гриппа H1N1 2009 года чувствителен к ингибиторам нейраминидазы, в том числе к занамивиру, в отличие от амантадинов[10].
Безопасность
В клинических испытаниях занамивира у взрослых не было повышенного риска по сравнению с осельтамивиром. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные[3].
Занамивир относится к медикаментам «
См. также
Примечания
- ↑ FDA Approves a Second Drug for the Prevention of Influenza A and B in Adults and Children FDA press release March 29, 2006. FDA. Дата обращения: 22 марта 2021. Архивировано из оригинала 6 марта 2010 года.
- ↑ О противовирусных препаратах. www.euro.who.int (20 февраля 2020). Дата обращения: 20 февраля 2020. Архивировано 2 марта 2020 года.
- ↑ .
- ↑ Varghese, J. N.; Laver, W. G.; Colman, P. M. (1983). Structure of the influenza virus glycoprotein antigen neuraminidase at 2.9 a resolution. Nature. 303 (5912): 35–40. doi:10.1038/303035a0. PMID 6843658.
- ↑ Archived copy. Дата обращения: 2 октября 2013. Архивировано из оригинала 4 октября 2013 года.
- ↑ Archived copy. Дата обращения: 2 октября 2013. Архивировано из оригинала 5 октября 2013 года.
- ↑ Meindl P, Bodo G, Palese P, Schulman J, Tuppy H (April 1974). Inhibition of neuraminidase activity by derivatives of 2-deoxy-2,3-dehydro-N-acetylneuraminic acid. Virology. 58 (2): 457–63. doi:10.1016/0042-6822(74)90080-4. PMID 4362431.
- ↑ Michiels, B.; Van Puyenbroeck, K.; Verhoeven, V.; Vermeire, E.; Coenen, S. (2013). The value of neuraminidase inhibitors for the prevention and treatment of seasonal influenza: a systematic review of systematic reviews. PLOS One. 8 (4): e60348. Bibcode:2013PLoSO...860348M. doi:10.1371/journal.pone.0060348. PMC 3614893. PMID 23565231.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - Centers for Disease Control and Prevention (CDC) (21 августа 2009). Дата обращения: 22 марта 2021. Архивировано9 июля 2017 года.
- ↑ Роспотребнадзор. — Письмо Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Чеченской Республике №01/5583-9-23 от 26.04.2009. Дата обращения: 13 февраля 2019. Архивировано14 февраля 2019 года.
- ↑ Смирнова, Т. Д. Участите цитоскелета клетки в инфекционном цикле вирусов гриппа A : НИИ гриппа Минздрава РФ, СПб. : [арх. 4 декабря 2018] / Т. Д. Смирнова, Д. М. Даниленко, А. В. Слита // Цитология : журн.. — 2013. — Т. 55, № 2. — С. 94.
- .
- ↑ Hayden FG (December 2001). Perspectives on antiviral use during pandemic influenza. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1416): 1877–84. doi:10.1098/rstb.2001.1007. PMC 1088564. PMID 11779387.
- ↑ FDA Approves a Second Drug for the Prevention of Influenza A and B in Adults and Children. FDA press release. Дата обращения: 22 марта 2021. Архивировано из оригинала 6 марта 2010 года.
- ↑ Safe and Appropriate Use of Influenza Drugs. Public Health Advisories (Drugs). U.S. Food and Drug Administration (FDA) (30 апреля 2009). Дата обращения: 11 ноября 2009. Архивировано 4 ноября 2009 года.
- ↑ Архивированная копия. Дата обращения: 24 марта 2021. Архивировано из оригинала 18 января 2017 года.
- ↑ Moscona A (September 2005). Neuraminidase inhibitors for influenza. The New England Journal of Medicine. 353 (13): 1363–73. doi:10.1056/NEJMra050740. PMID 16192481. Архивировано 29 августа 2021. Дата обращения: 24 марта 2021.
- ↑ Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza : Recommendations of the Advisory Committee on Immunization Practices : Recommendations and Reports : [англ.] : [арх. 2 сентября 2021] : pdf / Prepared by Anthony E. Fiore (MD), Alicia Fry (MD), David Shay (MD), Larisa Gubareva (PhD), Joseph S. Bresee (MD), Timothy M. Uyeki (MD), Influenza Division, National Center for Immunization and Respiratory Diseases. — Morbidity and Mortality Weekly Report. — Centers for Disease Control and Prevention, 2011. — Vol. 60, № 1 (21 January). — P. 6−7. — ISSN 1546-0738.
- ↑ Jefferson, T; Jones, MA; Doshi, P; Del Mar, CB; Hama, R; Thompson, MJ; Spencer, EA; Onakpoya, I; Mahtani, KR; Nunan, D; Howick, J; Heneghan, CJ (10 апреля 2014). Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children (PDF). The Cochrane Database of Systematic Reviews. 4 (4): CD008965. doi:10.1002/14651858.CD008965.pub4. PMC 6464969. PMID 24718923. Архивировано (PDF) 14 мая 2021. Дата обращения: 24 марта 2021.
- ↑ Heneghan, CJ; Onakpoya, I; Thompson, M; Spencer, EA; Jones, M; Jefferson, T (2014-04-09). Zanamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ (Clinical Research Ed.). 348: g2547. doi:10.1136/bmj.g2547. PMC 3981976. PMID 24811412.
- ↑ Heneghan, C. J.; Onakpoya, I.; Thompson, M.; Spencer, E. A.; Jones, M.; Jefferson, T. (9 апреля 2014). Zanamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ. 348 (apr09 2): g2547. doi:10.1136/bmj.g2547. PMC 3981976. PMID 24811412.