Строение бактериальной клетки

Бактериа́льная кле́тка обычно устроена наиболее просто по сравнению с клетками других живых организмов. Бактериальные клетки часто окружает капсула, которая служит защитой от внешней среды. Для многих свободноживущих бактерий характерно наличие жгутиков для передвижения, а также ворсинок.
Для выведения веществ, в том числе
Размеры
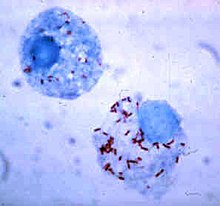
Как правило, размеры клеток бактерий находятся в пределах от 0,2 до 10
Бактерий, клетки которых составляют менее 0,5 мкм в диаметре, называют нанобактериями, или
Морфология

Форма бактериальной клетки является диагностическим признаком и применяется в их классификации. Чаще всего бактериальные клетки имеют сферическую (
Часто бактериальные клетки образуют устойчивые сочетания, такие как пары палочек (диплобациллы) или кокков (диплококки), цепочки палочек (стрептобациллы) или кокков (стрептококки), тетрады, пакеты из 4, 8 и более кокков (сарцины), гроздья (стафилококки). Некоторые бактерии образуют розетки, плоские таблички, сети, а также прямые или ветвящиеся трихомы — цепочки плотно примыкающих друг к другу клеток.
Известны бактерии с клетками весьма необычной формы (например, звёздчатые), некоторые бактерии (

Деление бактериальных клеток
В отличие от
В то же время есть примеры неравноценного деления. Например, у грамотрицательной бактерии Caulobacter crescentus[англ.] одна из дочерних клеток подвижная, у неё есть один жгутик для хемотаксиса. Вторая клетка остаётся прикреплённой к субстрату «стебельком». Подвижные клетки дифференцируются в клетки со стеблем после короткого периода свободного плавания. Репликация хромосом и деление клеток происходят только на стадии прикреплённой клетки[9].
В оптимальных условиях бактерии растут и делятся очень быстро, описан пример морской псевдомонады, популяция которой может удваиваться каждые 9,8 минуты[10].
Клеточная мембрана

Как любая живая клетка, бактериальная клетка окружена
Помимо
Клеточная стенка

В зависимости от типа строения клеточной стенки бактерии подразделяют на
Клеточная стенка механически стабилизирована и противостоит внутреннему давлению (
| Характеристика клеточных стенок грамположительных, грамотрицательных и кислотоустойчивых бактерий[19] | |||
|---|---|---|---|
| Свойство | Грам-положительные бактерии | Грам-отрицательные бактерии | Кислотоустойчивые[англ.] бактерии |
| Пептидогликан | Толстый слой | Тонкий слой | Относительно небольшое количество |
| Тейхоевая кислота | Часто присутствует | Отсутствует | |
| Липиды | Очень мало присутствует | Липополисахарид | Миколовая кислота, другие воски и гликолипиды |
| Внешняя мембрана
|
Отсутствует | Присутствует | Отсутствует |
| Периплазматическое пространство | Отсутствует | Присутствует | Отсутствует |
| Форма клетки | Всегда жесткая | Жесткая или гибкая | |
| Результаты ферментативного расщепления | Протопласт | Сферопласт | Трудно расщепить |
| Восприимчивость к красителям и антибиотикам | Самая восприимчивая | Умеренно восприимчивая | Наименее восприимчивая |
| Примеры | Staphylococcus aureus | Escherichia coli | Mycobacterium tuberculosis |
Химическое строение

Грамположительные бактерии

У грамположительных бактерий поверх мембраны есть (от 20 до 50 .
Кроме пептидогликана, в клеточной стенке грамположительных бактерий имеются
Поскольку у грамположительных бактерий слой пептидогликана не прикрыт сверху мембраной, перед ними стоит проблема удержания поверхностных белков. В ряде случаев поверхностные белки при помощи специальных
У микобактерий, нокардий и коринебактерий 30 % вещества клеточной стенки составляют липиды, причём у некоторых микобактерий в ней также образованы воски. Такую обогащённую липидами клеточную стенку иногда называют микомембраной. Микомембрана защищает бактерий от неблагоприятных условий среды и антимикробных препаратов[26]. У бактерий родов Mycobacterium, Nocardia, Corynebacterium, Rhodococcus[англ.] и Caseobacter в клеточной стенке обнаруживаются миколовые кислоты. Помимо полисахаридов, у ряда патогенных грамположительных бактерий в клеточных стенках присутствуют белки, например, белок А у стафилококков, который служит важным антигеном. Кроме того, с клеточной стенкой временно, перед высвобождением в окружающую среду, связываются энтеротоксины[англ.][27].
Грамотрицательные бактерии

У грамотрицательных бактерий поверх клеточной мембраны тоже залегает слой пептидогликана, однако он значительно (почти в 40 раз[17]) тоньше, чем у грамположительных бактерий, и прикрыт сверху второй мембраной. Клеточная и наружная мембраны отличаются по химическому составу. Пространство между клеточной и наружной мембранами называется периплазматическим пространством (периплазмой)[28].
В периплазматическом пространстве находится много разнообразных белков: разрушающие биологические молекулы ферменты,

Наружная мембрана состоит из двух асимметричных слоёв: внутренний слой, обращённый к клетке, состоит из фосфолипидов, а внешний — из
От наружной мембраны могут образовываться так называемые
В клетке грамотрицательной бактерии имеется от 200 до 400 зон слипания между наружной и клеточной мембранами, которые называют контактами Байера. В области контактов Байера в пептидогликановом слое имеется крупное отверстие, благодаря чему наружная и клеточная мембраны могут сблизиться вплотную. Адгезию мембран могут обеспечивать компоненты некоторых экспортных комплексов. Контакты Байера могут служить для выделения наружу различных молекул, например, субъединиц пилей, кроме того, к ним прикрепляются некоторые бактериофаги[34].
Из-за наличия дополнительного барьера проницаемости (наружной мембраны) для достижения необходимого эффекта грамотрицательные бактерии требуют больших концентраций антибиотиков, чем грамположительные бактерии. Наружная мембрана обеспечивает взаимодействия клеток друг с другом, с клетками организма-хозяина (при патогенезе) и с поверхностью субстрата. Она удерживает такие внешние структурные образования, как пили[30].
У цианобактерий поверх слоя пептидогликана располагается внешняя мембрана, однако с пептидогликаном ковалентно связаны полисахариды, из-за которых, судя по всему, цианобактерии окрашиваются по Граму положительно. Кроме того, наружная мембрана цианобактерий содержит каротиноиды[22].
Формирование клеточной стенки
Синтез пептидогликана протекает в несколько этапов. Дисахариды его гликановых цепей синтезируются в
Согласно одной из предложенных моделей, при росте клетки в клеточную стенку сначала добавляются новые нити, и лишь потом происходит разрыв старых связей. У большинства бактерий в клеточной стенке находится множество ферментов автолиза, которые разрушают различные химические связи в пептидогликане[35].
Системы секреции
Под системами секреции у бактерий понимают белковые комплексы, расположенные в клеточной мембране бактерий и служащие для выведения во внешнюю среду различных веществ. В частности, их используют патогенные бактерии для выделения факторов вирулентности[англ.] (преимущественно белковой природы). На основании состава, структура и действия системы секреции делят на несколько типов. Существует по меньшей мере шесть типов систем секреции, специфичных для грамотрицательных бактерий, четыре типа систем секреции уникальны для грамположительных бактерий, а два типа систем секреции имеются у обеих групп бактерий. Типы бактериальных систем секреции и их основные свойства приведены в таблице ниже[26].
| Система секреции | Сигнал секреции | Количество этапов секреции | Уложен ли субстрат | Количество мембран | Грам(+) или грам(-) |
|---|---|---|---|---|---|
| Sec | N-концевой | 1 | Нет | 1 | Обе группы |
| Tat | N-концевой | 1 | Да | 1 | Обе группы |
| I тип | C-концевой | 1 | Нет | 2 | Грам(-) |
| II тип | N-концевой | 2 | Да | 1 | Грам(-) |
| III тип | N-концевой | 1—2 | Нет | 2—3 | Грам(-) |
| IV тип | C-концевой | 1 | Нет | 2—3 | Грам(-) |
| V тип | N-концевой | 2 | Нет | 1 | Грам(-) |
| VI тип | Неизвестен | 1 | Неизвестно | 2—3 | Грам(-) |
| SecA2 | N-концевой | 1 | Нет | 1 | Грам(+) |
| Сортазы | N-концевой (Sec) C-концевой (cws) |
2 | Да | 1 | Грам(+) |
| Инжектосомы | N-концевой | 2 | Да | 1 | Грам(+) |
| VII тип | C-концевой | 1 | Да | 1—3 | Грам(+) |
Внеклеточные структуры
Капсула
У многих бактерий поверх клеточной стенки или внешней мембраны залегает капсула, состоящая из
S-слой
Поверхность некоторых бактерий (как грамположительных, так и грамотрицательных) покрыта S-слоем, состоящим из упорядоченно уложенных
Жгутик

Большинство бактерий подвижны, и их подвижность обеспечивается одним или нескольким жгутиками, которые представляют собой поверхностные белковые структуры. Расположение жгутиков на клетке может быть различным. У монотрихов имеется только один жгутик, у лофотрихов на одном из полюсов клетки находится пучок жгутиков, у амфитрихов на противоположных полюсах клетки находится по одному жгутику, а у перитрихов многочисленные жгутики разбросаны по всей поверхности клетки. Длина жгутика варьирует, но диаметр обычно составляет 20 нм[38].
Основание бактериального жгутика представлено базальным телом, состоящим из двух (у грамположительных) или четырёх (у грамотрицательных бактерий) белковых колец, стержня и моторных белков. От базального тела отходит крючок, переходящий в филамент, который завершается «шапочкой». Филамент представляет собой жёсткий цилиндр, образованный белком
При сборке жгутика сначала в мембране клетки появляется MS-кольцо, к которому прикрепляются моторные белки, далее формируются P- и L-кольца (у грамотрицательных бактерий), крючок и филамент. В такой же последовательности запускается экспрессия генов, кодирующих белки соответствующей части жгутика[40]. Через полое внутреннее пространство базального тела новые флагеллиновые субъединицы поступают к вершине растущего жгутика, где самоорганизуются по спирали. Чтобы субъединицы флагеллина не уходили во внешнюю среду, конец растущего филамента прикрыт «шапочкой», которая не даёт им покинуть жгутик. В среднем зрелый филамент состоит из около 20 тысяч молекул флагеллина, а белки жгутика кодируются более чем 30 генами[41].
Вероятно, движущей силой вращения жгутика у бактерий является
Движение клетки происходит за счёт вращения жгутика по часовой стрелке или против неё. У монотрихов клетка медленно вращается в направлении, противоположном вращению жгутика. Если жгутик вращается по часовой стрелке, то клетка движется жгутиком вперёд, а если против, то клетка выталкивается жгутиком вперёд (то есть движется жгутиком назад). Некоторые бактерии, имеющие единственный жгутик, вращают его только по часовой стрелке, и, чтобы сменить направление движения, им нужно остановиться и переориентироваться. У перитрихов жгутики вращаются против часовой стрелки, и, если нужно сменить направление движения, клетка останавливается и совершает кувырок[42].
У некоторых бактерий рода
Пили

Пили (также известны как фимбрии или ворсинки) — нитевидные белковые структуры, расположенные на поверхности клеток многих бактерий. Размер пилей варьирует от долей мкм до более чем 20 мкм в длину и 2—11 нм в диаметре. Пили участвуют в передаче генетического материала между бактериальными клетками (конъюгация), прикреплении бактерий к субстрату и другим клеткам, отвечают за адаптацию организмов, служат местами прикрепления многих бактериофагов. Структурно пили могут быть от тонких нитевидных образований до толстых палочкообразных структур с осевыми отверстиями. Пили состоят из одного или нескольких типов спирально уложенных белковых молекул, которые называют пилинами[англ.] или фимбринами[50]. В образовании пилей, помимо самих белков-пилинов, участвуют дополнительные белки, способствующие правильной сборке. У грамотрицательных бактерий они должны пройти через клеточную мембрану, периплазматическое пространство и наружную мембрану[51].
Прочие внеклеточные структуры
Иногда слизистая структура окружает не отдельную клетку, как в случае капсулы, а скопление клеток, и тогда покровную слизистую структуру называют чехлом. Чехлы могут покрывать не только вегетативные клетки, но и другие варианты дифференцированных клеток, например, покоящиеся структуры (цисты, эндоспоры, гетероцисты). Чехлы имеются, например, у внутриклеточных паразитических[англ.] хламидий и цианобактерий[52].
У некоторых грамотрицательных бактерий, в частности, цианобактерий, псевдомонад[англ.], метилотрофных бактерий, имеются особые поверхностные полые белковые структуры — шипы. Шипы представляют собой жёсткие полые конические или конусообразно-цилиндрические структуры, которые прикреплены к наружной мембране. В среднем на клетку приходится 10 шипов. Диаметр шипов составляет 50—100 нм, длина — 0,5—3 мкм. Стенка шипа толщиной около 7 нм образована спирально уложенными молекулами белка спинина. Конусообразно-цилиндрические шипы имеют открытый конец, у конических конец запечатан. Шипы образуются путём самосборки. Их функции неясны, возможно, шипы задействованы в образовании микроколоний, прикреплении к субстратам и клеткам, защите от фаготрофных протистов[53].
У бактерии Bacillus vesiculiferous, которая живёт в бедном кислородом кишечнике рачков, и некоторых других бактерий имеются так называемые газовые баллоны — крупные структуры, наполненные газом и прикреплённые к поверхности клетки. Они представляют собой сферические, цилиндрические или игольчатые везикулы, стенка которой представлена мембраной толщиной около 2 нм. Вероятно, газовые баллоны служат для запасания кислорода[54].
У бактерий из типа Фирмикуты, способных к ферментативному разрушению целлюлозы, соответствующие ферменты — целлюлазы — находятся в особой структуре, целлюлосоме, которая находится в экзоплазматическом компартменте. Целлюлосома — очень крупный (от 2 тысяч до 6,5 тысяч кДа) белковый комплекс, состоящий из 14—26 белков. Целлюлосома способствует прикреплению бактерий к субстрату, обеспечивает оптимальное взаимодействие с ним целлюлаз и поступление продуктов гидролиза целлюлозы к поверхности клетки[55].
У некоторых цианобактерий в экзоплазматическом компартменте формируются
.Внутриклеточные структуры
Нуклеоид и плазмиды

Количество хромосом в бактериальной клетке зависит не только от
За компактизацию бактериальной хромосомы отвечают несколько разнородных белков, из которых наиболее важны HU, H-NS и SMC. Белки HU и H-NS называют гистоноподобными, их взаимодействие с ДНК зависит от её
Плазмиды — это стабильные элементы внехромосомной ДНК, которые не являются строго необходимыми для функционирования бактериальной клетки. Гены, содержащиеся на плазмидах, дают своим обладателям полезные свойства, увеличивающие их приспособленность, — например, гены, отвечающие за производство антибиотиков и
Рибосомы
Как и у других клеток, рибосома у бактерий состоит из большой и малой субъединиц, имеющих
Гены рРНК объединены в один или несколько
Цитоскелет

Долгое время считалось, что у прокариот
Тельца включения
В клетках многих бактерий обнаруживаются небольшие гранулы разнообразных соединений — полисахаридов,
Многие бактерии содержат
В редких случаях в цитоплазме бактерий обнаруживаются
Некоторые
Специализированные внутриклеточные структуры
Карбоксисомы

Эти органеллы обнаружены у всех цианобактерий и многих хемотрофных бактерий, фиксирующих CO2[79]. Карбоксисомы содержат
Существует два вида карбоксисом: α-карбоксисомы и β-карбоксисомы, которые отличаются по своему белковому составу. В α-карбоксисомах содержится Рубиско I типа, которая распределена несколькими слоями, а гены, ответственные за синтез белков карбоксисомы, организованы в один оперон. В β-карбоксисомах содержится Рубиско II типа, у которой нет малых регуляторных субъединиц и которая организована в плотную паракристаллическую структуру при помощи специального белка, а её гены образуют несколько независимых кластеров[81].
Магнитосомы

Магнитосомы представляют собой окружённый мембраной цельный
Хлоросомы

Хлоросомами называют
.Газовые везикулы
У многих водных бактерий, особенно цианобактерий, имеются газовые везикулы, которые служат для регуляции плавучести. Мембрана, ограничивающая газовую везикулу, имеет белковую природу, а внутри газовой везикулы находится
Мезосомы

В 1953 году на
Прочие внутриклеточные структуры
Изредка в бактериальных клетках встречаются
В клетках Agrobacterium tumefaciens содержатся
У многих нитчатых цианобактерий имеются керитомические вакуоли, которые имеют сферическую форму, кристаллическое или аморфное содержимое и окружены мембраной. Скорее всего, в них запасаются органические вещества. Функции керитомических вакуолей неизвестны; возможно, они изолируют вредные продукты метаболизма[97].
Дифференцированные бактериальные клетки
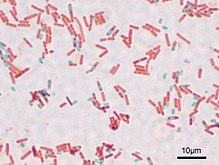
Многие бактерии способны образовывать особые покоящиеся формы, предназначенные для переживания неблагоприятных условий. Многие грамположительные бактерии, а именно представители родов
Споруляция (процесс образования спор) запускается неблагоприятными факторами окружающей среды. В клетке образуются впячивания клеточной мембраны, которые, смыкаясь, разделяют её септой на две части. Меньшая из них превращается в эндоспору, наращивает кортекс и многослойную оболочку. В конце концов материнская клетка погибает, и эндоспора, генетически идентичная материнской клетке, выходит наружу. Таким образом, вегетативная клетка может дать начало только одной эндоспоре, поэтому образование эндоспор не является способом размножения. Прорастание споры происходит в благоприятных условиях. После активации начинаются созревание и прорастание споры, в результате которых клетка покидает споровые оболочки и выходит во внешнюю среду[99].
Под цистами понимают умеренно покоящиеся и слаборезистентные клетки, которые образуются непосредственно путём
Цианобактерии образуют специализированные структуры и клетки, предназначенные для размножения и расселения. К их числу относятся особые клетки — беоциты, образуемые плеврокапсовыми цианобактериями. Беоциты в два раза меньше по объёму, чем материнские клетки, и образуются в результате её дробления, а не бинарного деления[101].

Также у цианобактерий описаны
У бактерий, формирующих азотфиксирующие клубеньки на
Примечания
- ↑ Нетрусов, Котова, 2012, с. 31.
- ↑ Пиневич, 2006, с. 157—159.
- ]
- ↑ Нетрусов, Котова, 2012, с. 35—36.
- ]
- ]
- ↑ Benjamin Lewin. Chapter 13: The replicon // Genes VIII. — Upper Saddle River, NJ: Pearson Prentice Hall, 2004. — ISBN 0131439812.
- ]
- ↑ 1 2 Ausmees N., Kuhn J. R., Jacobs-Wagner C. The bacterial cytoskeleton: an intermediate filament-like function in cell shape. (англ.) // Cell. — 2003. — Vol. 115, no. 6. — P. 705—713. — PMID 14675535.
- ↑ EAGON RG. Pseudomonas natriegens, a marine bacterium with a generation time of less than 10 minutes. (англ.) // Journal Of Bacteriology. — 1962. — April (vol. 83). — P. 736—737. — PMID 13888946.
- ↑ Пиневич, 2006, с. 181—182.
- ↑ Пиневич, 2006, с. 170—177.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 54.
- ]
- ↑ Куранова, Купатадзе, 2013, с. 29.
- ↑ Razin S., Yogev D., Naot Y. Molecular biology and pathogenicity of mycoplasmas. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 1998. — December (vol. 62, no. 4). — P. 1094—1156. — PMID 9841667.
- ↑ 1 2 3 Нетрусов, Котова, 2012, с. 48.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 928.
- ↑ Jacquelyn G. Black, Laura J. Black. Microbiology: Principles and Explorations, 9th Edition. — Wiley, 2014. — С. 85. — 960 с. — ISBN 978-1-118-74316-4.
- ↑ 1 2 Кассимерис, Лингаппа, Плоппер, 2016, с. 925.
- ↑ Нетрусов, Котова, 2012, с. 51.
- ↑ 1 2 Современная микробиология, 2005, с. 51.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 929—930.
- ↑ Нетрусов, Котова, 2012, с. 49, 51.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 930—931.
- ↑ ]
- ↑ Современная микробиология, 2005, с. 52.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 932.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 932—933.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 52.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 933—934.
- ↑ Нетрусов, Котова, 2012, с. 51—52.
- ↑ Пиневич, 2006, с. 255—256.
- ↑ Пиневич, 2006, с. 257.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 926—928.
- ↑ Пиневич, 2006, с. 302—303.
- ↑ Пиневич, 2006, с. 291—293.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 940—941.
- ↑ Нетрусов, Котова, 2012, с. 61.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 941.
- ↑ Нетрусов, Котова, 2012, с. 61—62.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 64.
- ↑ Kim Y. K., McCarter L. L. Analysis of the polar flagellar gene system of Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 2000. — July (vol. 182, no. 13). — P. 3693—3704. — PMID 10850984.
- ↑ Atsumi T., Maekawa Y., Yamada T., Kawagishi I., Imae Y., Homma M. Effect of viscosity on swimming by the lateral and polar flagella of Vibrio alginolyticus. (англ.) // Journal Of Bacteriology. — 1996. — August (vol. 178, no. 16). — P. 5024—5026. — PMID 8759871.
- ]
- ]
- ↑ Belas R., Simon M., Silverman M. Regulation of lateral flagella gene transcription in Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 1986. — July (vol. 167, no. 1). — P. 210—218. — PMID 3013835.
- ]
- ]
- ↑ Нетрусов, Котова, 2012, с. 54—56.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 939—940.
- ↑ Пиневич, 2006, с. 305—306.
- ↑ Пиневич, 2006, с. 307—308.
- ↑ Пиневич, 2006, с. 308.
- ↑ Пиневич, 2006, с. 309—310.
- ↑ Пиневич, 2006, с. 311.
- ↑ Нетрусов, Котова, 2012, с. 37—38.
- ↑ Пиневич, 2006, с. 194—195.
- ↑ Пиневич, 2006, с. 196—197.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 943.
- ↑ 1 2 Пиневич, 2006, с. 205.
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Нетрусов, Котова, 2012, с. 46—48.
- ]
- ↑ Пиневич, 2006, с. 230—231.
- ↑ Пиневич, 2006, с. 237—238.
- ↑ Пиневич, 2006, с. 232—233.
- ↑ Нетрусов, Котова, 2012, с. 46.
- ]
- ↑ Badger M. R., Price G. D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution. (англ.) // Journal of experimental botany. — 2003. — Vol. 54, no. 383. — P. 609—622. — PMID 12554704.
- ↑ Lee, R. E. Phycology, 4th edition. — Colorado State University, USA: Cambridge University Press, 2008. — P. 39. — 547 p. — ISBN 9780521682770. Архивировано 23 сентября 2016 года.
- ]
- ↑ Пиневич, 2006, с. 233—235.
- ]
- ]
- doi:10.1021/jp4011394.]
- ]
- ↑ Пиневич, 2006, с. 224—226.
- ↑ Suganuma A. Studies on the fine structure of Staphylococcus aureus. (англ.) // Journal Of Electron Microscopy. — 1966. — Vol. 15, no. 4. — P. 257—261. — PMID 5984369.
- ↑ Pontefract R. D., Bergeron G., Thatcher F. S. Mesosomes in Escherichia coli. (англ.) // Journal Of Bacteriology. — 1969. — January (vol. 97, no. 1). — P. 367—375. — PMID 4884819.
- ↑ Ebersold H. R., Cordier J. L., Lüthy P. Bacterial mesosomes: method dependent artifacts. (англ.) // Archives Of Microbiology. — 1981. — September (vol. 130, no. 1). — P. 19—22. — PMID 6796029.
- ↑ Higgins M. L., Tsien H. C., Daneo-Moore L. Organization of mesosomes in fixed and unfixed cells. (англ.) // Journal Of Bacteriology. — 1976. — September (vol. 127, no. 3). — P. 1519—1523. — PMID 821934.
- ↑ Santhana Raj L., Hing H. L., Baharudin O., Teh Hamidah Z., Aida Suhana R., Nor Asiha C. P., Vimala B., Paramsarvaran S., Sumarni G., Hanjeet K. Mesosomes are a definite event in antibiotic-treated Staphylococcus aureus ATCC 25923. (англ.) // Tropical Biomedicine. — 2007. — June (vol. 24, no. 1). — P. 105—109. — PMID 17568383.
- ↑ Friedrich C. L., Moyles D., Beveridge T. J., Hancock R. E. Antibacterial action of structurally diverse cationic peptides on gram-positive bacteria. (англ.) // Antimicrobial Agents And Chemotherapy. — 2000. — August (vol. 44, no. 8). — P. 2086—2092. — PMID 10898680.
- ↑ Balkwill D. L., Stevens Jr. S. E. Effects of penicillin G on mesosome-like structures in Agmenellum quadruplicatum. (англ.) // Antimicrobial Agents And Chemotherapy. — 1980. — March (vol. 17, no. 3). — P. 506—509. — PMID 6775592.
- ↑ Пиневич, 2006, с. 222—224.
- ↑ 1 2 Пиневич, 2006, с. 236.
- ↑ Нетрусов, Котова, 2012, с. 66—68.
- ↑ Нетрусов, Котова, 2012, с. 70—72.
- ↑ Нетрусов, Котова, 2012, с. 73.
- ↑ 1 2 3 4 Пиневич А. В. Микробиология. Биология прокариотов. — СПб.: Издательство С.-Петербургского университета, 2009. — Т. 3. — С. 240—257. — 457 с. — ISBN 978-5-288-04894-4.
Литература
- Пиневич А. В. Микробиология. Биология прокариотов: в 3 т. — СПб.: Издательство С.-Петербургского университета, 2006. — Т. 1. — 352 с. — ISBN 5-288-04057-5.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
- Современная микробиология / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. — Т. 1. — 654 с.
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
- Куранова Н. Г., Купатадзе Г. А. Микробиология. Часть 1. Прокариотическая клетка. — М.: Прометей, 2013. — 108 с. — ISBN 978-5-7042-2459-4.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |