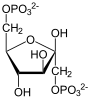
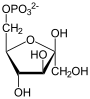
Фруктозо-1,6-бисфосфатаза
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
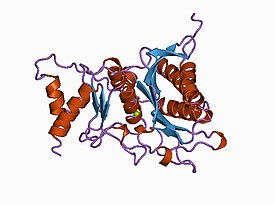 Кристаллическая структура фруктозы-1,6-бисфосфатазы печени кролика. Разрешение 2,3 ангстрем. | |
| Идентификаторы | |
| Символ | FBPase |
| Pfam | PF00316 |
| Pfam clan | CL0171 |
| InterPro | IPR000146 |
| PROSITE | PDOC00114 |
| SCOP | 1frp |
| SUPERFAMILY | 1frp |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Фруктозо-1,6-бисфосфатаза в твёрдом состоянии | |
|---|---|
 | |
| Идентификаторы | |
| Символ | FBPase_2 |
| Pfam | PF06874 |
| Pfam clan | CL0163 |
| InterPro | IPR009164 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
 Кристаллическая структура фруктозо-1,6-бисфосфатазы | |
| Идентификаторы | |
| Символ | FBPase_3 |
| Pfam | PF01950 |
| InterPro | IPR002803 |
| SCOP | 1umg |
| SUPERFAMILY | 1umg |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Фруктозо-1,6-бисфосфатаза, также Фруктозо-1,6-дисфосфатаза (ФБФ-аза, FBP сокр. от
Данная реакция протекает в
Ген, кодирующий данные фермент — FBP1, локализован на 9-ой хромосоме.
Структура
Было отмечено, что фолд фруктозо-1,6-бисфосфатазы свиньи идентичен инозитол-1-фосфатазе (ИМФ-азе)[3]. Инозитолполифосфат 1-фосфатаза (ИПФ-аза), ИМФ-аза и ФБФ-аза имеют
Распределение видов
Три различные группы фруктозо-1,6-бисфосфатазы были идентифицированы у эукариот и бактерий (ФБФ-азы I—III)[5]. Ни одна из этих групп до сих пор не была найдена в археях, однако, новая группа ФБФ-аз (ФБФ-азы IV), которая также проявляет свойства инозитол монофосфатазы, недавно выявлена у архей[6].
Новая группа ФБФ-аз (ФБФ-азы V) встречается в
Участие в лечении диабета
Фруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении сахарного диабета 2 типа. Это заболевание характеризуется гипергликемией (повышенной концентрацией глюкозы в крови), которая вызывает множество серьёзных проблем, и в лечении часто приходится акцентировать внимание на снижение уровня сахара в крови[8][9][10]. Усиленный глюконеогенез в печени является одной из основных причин перепродукции глюкозы у этих больных, и поэтому ингибирование глюконеогенеза является разумным способом для лечения сахарного диабета 2 типа.
Дефицит
Мутации в гене FBP1 могут приводить к наследственной недостаточности фруктозо-1,6-бисфосфатазы. Это аутосомно-рецессивное заболевание, характеризующееся нарушениям процесса глюконеогенеза, которые приводят к гипогликемии, лактатацидозу, гипервентиляции, судорогам и гипогликемической коме. Особенно опасны эти проявления среди новорождённых, так как среди них наблюдается высокая летальность.
Примечания
- .
- .
- .
- .
- .
- .
- .
- ]
- ↑ Hofmann, F.B. and Munchen. «Handbook of experimental pharmacology: Diabetes — perspectives in drug therapy.» Springer-Verlag Berlin Heidelverg 203 (2011). Web.
- ]