Фагоциты
Фагоци́ты (от
Фагоциты человека и других животных называют «профессиональными» или «непрофессиональными» в зависимости от того, насколько эффективно они фагоцитируют
При инфекции химические сигналы привлекают фагоциты к месту, где
История открытия

Хотя явление, позже названное фагоцитозом, впервые наблюдали
Год спустя Мечников изучал пресноводное
Хотя значение этих открытий постепенно получило признание в начале двадцатого века, сложный характер взаимоотношений между фагоцитами и другими компонентами иммунной системы не был известен вплоть до 1980-х годов[24].
Фагоцитоз

1. Несвязанные рецепторы на поверхности фагоцита не запускают фагоцитоз.
2. Связывание рецепторов вызывает их группирование.
3. Запускается фагоцитоз и частица поглощается фагоцитом
Фагоцитоз — процесс поглощения чужеродных частиц клетками[25]. Он включает последовательность молекулярных процессов[26]. Фагоцитоз возникает после связывания рецепторами чужеродного агента (например, бактерии). Затем фагоцит окружает бактерию и поглощает её. Фагоцитоз бактерии человеческим нейтрофилом происходит примерно за 9 минут[27]. Внутри фагоцита бактерия оказывается в составе фагосомы. В течение минуты фагосома сливается с лизосомой или гранулой, содержащими ферменты, с образованием фаголизосомы[англ.]. Заключённая бактерия подвергается агрессивному воздействию[28] и погибает через несколько минут[27]. Дендритные клетки и макрофаги действуют не так быстро, и фагоцитоз в этих клетках может протекать в течение многих часов. Макрофаги поглощают большое количество чужеродного материала и часто выделяют некоторые непереваренные частицы обратно. Этот материал является сигналом для миграции макрофагов из крови[29]. Фагоциты способны поглощать почти любое вещество.

Фагоциты имеют на своей поверхности множество различных рецепторов, благодаря которым они связывают чужеродный материал
Механизмы уничтожения чужеродных агентов

Уничтожение микроорганизмов — важная функция фагоцитоза[31], которая происходит либо при фагоцитозе (внутриклеточное уничтожение), либо вне фагоцита (внеклеточное уничтожение).
Внутриклеточный кислород-зависимый путь
Когда фагоцит поглощает бактерию (или любой другой чужеродный материал), увеличивается потребление кислорода, что называют респираторным взрывом[англ.]. При этом образуются активные формы кислорода, которые обладают противомикробным действием[32]. Соединения кислорода токсичны как для патогена, так и для самой клетки, поэтому они хранятся в ячейках внутри самой клетки. Такой метод уничтожения проникающих микроорганизмов называют кислород-зависимое внутриклеточное уничтожение, который делится на два типа[15].
Первый тип — кислород-зависимое образование
Ко второму типу относят использование фермента миелопероксидаза из нейтрофильных гранул[34]. Когда гранулы сливаются с фагосомой, миелопероксидаза освобождается в фаголизосому, и этот фермент использует пероксид водорода и хлор для создания гипохлорита. Гипохлорит крайне токсичен для бактерий[3]. Миелопероксидаза содержит пигмент гем, за счёт которого образуется зелёный цвет секретов, богатых нейтрофилами (например, гной, инфицированная мокрота)[35].
Внутриклеточный кислород-независимый путь
Фагоциты также могут уничтожать микроорганизмы кислород-независимым методом, но он менее эффективен, чем кислород-зависимый. Различают четыре основных типа. При первом типе используются заряженные белки, которые повреждают
.Внеклеточные пути
При некоторых заболеваниях, например, при редких хронических гранулёматозных заболеваниях, эффективность фагоцитоза нарушается, что может привести к возникновению бактериальных инфекций[41]. При таких заболеваниях существует аномалия в работе различных элементов кислород-зависимого уничтожения микробов. Другие редкие врождённые аномалии, например синдром Шедьяка — Штайнбринка — Хигаси[англ.], также связаны с дефектным уничтожением проникающих в организм микробов[42].
Вирусы
Вирусы могут воспроизводиться только внутри клетки, и они проникают в неё, используя множество рецепторов, участвующих в иммунной защите. Попав внутрь клетки, вирусы используют её биологические процессы в свою пользу, заставляя клетку создавать тысячи вирусных частиц, подобных материнской. Хотя фагоциты и другие компоненты иммунной системы могут в ограниченной степени контролировать вирусы, когда вирус внутри клетки, приобретённый иммунитет (в частности, лимфоциты) более важен для защиты[43]. В области вирусной инфекции лимфоцитов скапливается гораздо больше, чем остальных клеток иммунной системы, что наиболее типично для вирусного менингита[44]. Клетки, инфицированные вирусами, уничтожаются лимфоцитами и выводятся из организма фагоцитами[45].
Роль в апоптозе

У животных, растений и грибов клетки постоянно погибают. Баланс между делением клетки и их гибелью сохраняет относительно постоянное число клеток у взрослых[2]. Существует два механизма гибели клетки: некроз и апоптоз. В отличие от некроза, который чаще возникает как результат заболевания или травмы, апоптоз (или запрограммированная гибель клеток) — нормальный процесс, постоянно протекающий в организме. Организм избавляет себя от миллионов мёртвых или погибающих клеток каждый день, и фагоциты играют важную роль в этом процессе[46].
Погибающая клетка, которая подвергается финальной стадии апоптоза[47], экспонирует некоторые специфические молекулы (например, фосфатидилсерин) на своей поверхности для соединения с фагоцитом[48]. Фосфатидилсерин обычно находится на цитозольной поверхности плазматической мембраны, но перемещается при апоптозе на внешнюю поверхность предположительно с помощью белка под названием скрамблаза[англ.][49]. Эти молекулы помечают клетку для фагоцитоза клетками, которые обладают соответствующими рецепторами, например макрофаги[50]. Удаление погибающих клеток фагоцитами происходит упорядоченным образом, не вызывая воспаления[51].
Взаимодействие с другими клетками
Фагоциты движутся в организме, взаимодействуя с фагоцитарными и нефагоцитарными клетками иммунной системы. Они обмениваются информацией с другими клетками с помощью образования химических веществ, называемых
Презентация антигена
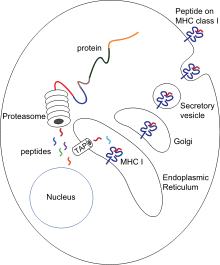
Презентация антигена — процесс, при котором некоторые фагоциты перемещают части поглощённого материала назад на свою поверхность и «предоставляют» их для других клеток иммунной системы
Иммунологическая толерантность
Дендритные клетки также способствуют иммунологической толерантности
Профессиональные фагоциты

Фагоциты человека и других позвоночных разделяют на «профессиональные» и «непрофессиональные» группы на основе эффективности, при которой они участвуют в фагоцитозе[9]. К профессиональным фагоцитам относят моноциты, макрофаги, нейтрофилы, тканевые дендритные клетки и тучные клетки[10].
| Основное расположение | Варианты фенотипов |
|---|---|
| Кровь | нейтрофилы, моноциты |
| Костный мозг | макрофаги, моноциты, синусоидальные клетки[англ.], обкладочные клетки |
| Костная ткань | остеокласты |
| Кишечник и кишечные Пейеровы бляшки | макрофаги |
| Соединительная ткань | Гистиоциты[англ.], макрофаги, моноциты, дендритные клетки |
| Печень | клетки Купфера, моноциты |
| Лёгкие | самовоспроизводящиеся макрофаги, моноциты, тучные клетки, дендритные клетки |
| Лимфатическая ткань | свободные и фиксированные макрофаги и моноциты, дендритные клетки |
| Нервная ткань | клетки микроглии (CD4+) |
| Селезёнка | свободные и фиксированные макрофаги, моноциты, синусоидные клетки |
| Тимус | свободные и фиксированные макрофаги и моноциты |
| Кожа | постоянные клетки Лангерганса, другие дендритные клетки, макрофаги, тучные клетки |
Активация
Все фагоциты, особенно макрофаги, находятся в состоянии готовности. Макрофаги, как правило, относительно пассивны в
В крови нейтрофилы неактивны, но движутся по ней с большой скоростью. Когда они получают сигналы от макрофагов из зоны воспаления, они замедляются и выходят из крови. В тканях они активируются цитокинами и поступают в зону действия готовыми уничтожать[66].
Миграция

Когда происходит инфекционное заражение, выделяется химический «SOS»-сигнал для привлечения фагоцитов в зону инфекции
Для достижения зоны инфекции фагоциты выходят из кровеносного русла и проникают в поражённую ткань. Сигналы от инфекции вызывают синтез эндотелиальными клетками, выстилающие кровеносный сосуд, белка, называемого селектин, который сцепляется с проходящими нейтрофилами. Вазодилататоры ослабляют соединительные связи эндотелиальных клеток, что позволяет фагоцитами проходить через стенку сосуда. Хемотаксис — процесс, при котором фагоциты следуют на «запах» цитокинов к области инфекции[3]. Нейтрофилы проникают через органы, покрытые эпителиальной тканью, в зону инфекции, и, хотя это важный компонент борьбы с инфекцией, миграция сама по себе может привести к возникновению симптомов заболевания[68]. При инфекции миллионы нейтрофилов вызываются из крови, но они погибают затем в течение нескольких дней[69].
Моноциты

Моноциты развиваются в костном мозге и достигают зрелости в крови. Зрелые моноциты имеют крупное, гладкое, дольчатое ядро и цитоплазму, которая содержит гранулы. Моноциты поглощают чужеродные или опасные вещества и презентируют антигены другим клеткам иммунной системы. Моноциты образуют 2 группы: циркулирующая и краевая, которые остаются в других тканях (около 70 % находятся в краевой группе). Большинство моноцитов покидают кровеносное русло через 20—40 часов, попадая в ткани и органы, где они превращаются в макрофаги[70] или дендритные клетки в зависимости от получаемого сигнала[71]. В 1 литре крови человека находится около 500 миллионов моноцитов[13].
Макрофаги
Зрелые макрофаги не перемещаются далеко, но стоят на страже в тех областях организма, которые подвержены воздействию внешней среды. Там они действуют как сборщики мусора.

Этот вид фагоцитов не имеет гранул, но содержит много
Макрофаги могут быть активированы для выполнения функций, которые покоящийся моноцит не может осуществлять
Нейтрофилы
Нейтрофилы обычно находятся в кровеносном русле и являются наиболее распространённым типом фагоцитов, составляя 50—60 % от всех циркулирующих в крови белых кровяных клеток[79]. Один литр крови взрослого человека в норме содержит около 2,5—7,5 миллиардов нейтрофилов[13]. Их диаметр составляет около 10 мкм[80], и живут нейтрофилы только в течение 5 дней[40]. Как только поступает соответствующий сигнал, они в течение примерно 30 минут выходят из крови и достигают зоны инфекции[81]. Они способны быстро поглощать чужеродный материал. Нейтрофилы не возвращаются в кровь, а превращаются в клетки гноя и погибают[81]. Зрелые нейтрофилы меньше, чем моноциты, и имеют сегментированные ядра с несколькими секциями; каждая секция соединяется с хроматиновыми нитями (нейтрофил может иметь 2—5 сегментов). Обычно нейтрофилы не выходят из костного мозга до наступления зрелости, но при инфекции высвобождаются в кровь предшественники нейтрофилов — миелоциты и промиелоциты[82].
Внутриклеточные гранулы нейтрофилов человека разрушают белки и обладают
Дендритные клетки

Дендритные клетки — специализированные антиген-презентирующие клетки, у которых есть длинные отростки, называемые
Зрелые дендритные клетки активируют
Тучные клетки
Тучные клетки имеют
Непрофессиональные фагоциты
Умирающие клетки и чужеродные организмы поглощаются клетками, отличными от «профессиональных» фагоцитов[98]. К таким клеткам относят эпителиальные, эндотелиальные, паренхиматозные клетки и фибробласты. Их называют непрофессиональными фагоцитами, чтобы подчеркнуть, что, в отличие от профессиональных фагоцитов, фагоцитоз для них не является основной функцией[99]. Фибробласты, например, которые могут фагоцитировать коллаген в процессе рассасывания рубцов, также способны частично поглощать чужеродные частицы[100].
Непрофессиональные фагоциты более ограничены, чем профессиональные, в отношении частиц, которые они могут поглотить. Это связано с отсутствием у них эффективных фагоцитарных рецепторов, в частности опсонинов[12]. Кроме того, большинство непрофессиональных фагоцитов не образуют реактивные кислород-содержащие молекулы для фагоцитоза[101].
| Основное расположение | Варианты фенотипов |
|---|---|
| Кровь, лимфа и лимфатические узлы | Лимфоциты |
| Кровь, лимфа и лимфатические узлы | Естественные киллеры и крупные гранулярные лимфоциты |
| Кожа | Эпителиоциты |
| Кровеносные сосуды | Эндотелиоциты |
| Соединительная ткань | Фибробласты |
| Кровь | Эритроциты
|
Устойчивость патогена
Патоген вызывает инфекцию, если только он преодолел защитные рубежи организма. Патогенные бактерии и простейшие развивают различные механизмы устойчивости к атакам фагоцитов, и многие из них действительно выживают и размножаются внутри фагоцитирующих клеток[102][103].
Избежание контакта
У бактерий есть несколько способов избежать контакта с фагоцитами. Во-первых, они могут жить в местах, куда фагоциты не способны попасть (например, повреждённый кожный покров). Во-вторых, бактерия может подавлять реакцию воспаления; без воспаления фагоциты не способны реагировать на инфекцию адекватно. В-третьих, некоторые виды бактерий могут замедлять способность фагоцитов перемещаться в зону инфекции, препятствуя хемотаксису[102]. В-четвёртых, некоторые бактерии способны избегать контакта с фагоцитом путём обмана иммунной системы, которая начинает «думать», что бактерия — клетка самого макроорганизма. Бледная трепонема (бактерия, вызывающая сифилис) скрывается от фагоцитов, покрывая свою поверхность фибронектином[104], который естественно образуется в организме и играет важную роль в заживлении раны[105].
Избежание поглощения
Бактерии часто образуют белки или сахара, которые покрывают их клетки и препятствуют фагоцитозу; они входят в состав
Выживание внутри фагоцита
У бактерий развиты способы выживания внутри фагоцитов, где они продолжают уклоняться от иммунной системы
Уничтожение
У бактерий развиты некоторые способы уничтожения фагоцитов.
Нарушение передачи сигнала в клетке
Некоторые стратегии выживания часто связаны с нарушением цитокиновой передачи и других методов
Повреждение макроорганизма фагоцитами
Макрофаги и нейтрофилы, в частности, играют центральную роль в воспалительном процессе путём высвобождения белков и низкомолекулярных воспалительных медиаторов, которые контролируют инфекцию, но могут повреждать ткани макроорганизма. В общем, цель фагоцитов — разрушение патогенов путём поглощения их и последующего воздействия на них токсичными веществами внутри фаголизосом. Если фагоцит не в состоянии поглотить свою цель, эти токсические агенты могут быть выделены в окружающую среду (действие называется «фрустрированный фагоцитоз»). Так как эти агенты токсичны и для клеток макроорганизма, они могут вызвать значительное повреждение здоровых клеток и тканей[120].
Если нейтрофилы освобождают содержимое гранул (активные формы кислорода и
Нейтрофилы также играют ключевую роль в развитии большинства форм острого повреждения лёгких
Химические вещества, высвобождаемые макрофагами, могут также повреждать ткани организма. Фактор некроза опухоли-α (ФНО-α) — важное химическое вещество, выделяемое макрофагами, которое приводит к свёртыванию крови в мелких сосудах, что предотвращает распространение инфекции[126]. Однако, если бактериальная инфекция проникает в кровь, ФНО-α выделяется в жизненно важных органах, где может вызвать вазодилатацию и уменьшить объём плазмы; это, в свою очередь, может привести к септическому шоку. При септическом шоке высвобождение ФНО-α вызывает блокаду мелких сосудов, которые снабжают кровью жизненно важные органы, и может возникнуть их недостаточность. Септический шок может привести к смерти[14].
Эволюционное происхождение
Фагоцитоз, вероятно, появился на ранних этапах
См. также
Примечания
- ↑ Little, C., Fowler H.W., Coulson J. The Shorter Oxford English Dictionary (англ.). — Oxford University Press (Guild Publishing), 1983. — P. 1566—1567.
- ↑ 1 2 Thompson C. B. Apoptosis in the pathogenesis and treatment of disease. (англ.) // Science (New York, N.Y.). — 1995. — Vol. 267, no. 5203. — P. 1456—1462. — PMID 7878464.
- ↑ 1 2 3 4 5 6 7 8 9 10 Gene Mayer. Immunology — Chapter One: Innate (non-specific) Immunity. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Дата обращения: 12 ноября 2008. Архивировано 23 августа 2011 года.
- ↑ 1 2 Delves, Martin, Burton, Roit, 2006, p. 250.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 251.
- ↑ Ilya Mechnikov. Дата обращения: 12 сентября 2010. Архивировано 17 февраля 2015 года.
- ↑ ]
- ↑ 1 2 Janeway C. A. Jr. Evolution of the innate immune system. Дата обращения: 3 октября 2017. Архивировано 31 декабря 2022 года.
- ↑ 1 2 Ernst, Stendahl, 2006, p. 186.
- ↑ 1 2 Robinson, Babcock, 1998, p. 187.
- ↑ Ernst, Stendahl, 2006, p. 7—10.
- ↑ 1 2 Ernst, Stendahl, 2006, p. 10.
- ↑ 1 2 3 Hoffbrand, Pettit, Moss, 2005, p. 331.
- ↑ 1 2 3 Janeway C. A. Jr. Induced innate responses to infection. Дата обращения: 3 октября 2017. Архивировано 31 декабря 2022 года.
- ↑ ]
- ↑ 1 2 Janeway C. A. Jr. Antigen Presentation to T Lymphocytes.
- ]
- ↑ Fetal and Neonatal Physiology. 5th edition / Ed. by R. A. Polin, S. H. Abman, D. H. Rowitch, W. E. Benitz, W. W. Fox. — Philadelphia: Elsevier Health Sciences, 2016. — xxxvii + 2050 p. — ISBN 978-0-323-35214-7. Архивировано 31 декабря 2016 года. — P. 1221.
- doi:10.1038/ni0708-705.]
- ↑ Delves, Martin, Burton, Roit, 2006, p. 3.
- ↑ Aterman K. Medals, memoirs--and Metchnikoff. (англ.) // Journal of leukocyte biology. — 1998. — Vol. 63, no. 4. — P. 515—517. — PMID 9544583.
- ↑ Ilya Mechnikov. The Nobel Foundation. Дата обращения: 28 ноября 2008. Архивировано 10 февраля 2012 года.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 263.
- ↑ Robinson, Babcock, 1998, p. vii.
- ↑ Ernst, Stendahl, 2006, p. 4.
- ↑ Ernst, Stendahl, 2006, p. 78.
- ↑ 1 2 Hampton M. B., Vissers M. C., Winterbourn C. C. A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils. (англ.) // Journal of leukocyte biology. — 1994. — Vol. 55, no. 2. — P. 147—152. — PMID 8301210.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 6—7.
- ↑ Sompayrac, 2008, p. 3.
- ↑ Sompayrac, 2008, p. 13—16.
- ]
- ↑ Dahlgren C., Karlsson A. Respiratory burst in human neutrophils. (англ.) // Journal of immunological methods. — 1999. — Vol. 232, no. 1-2. — P. 3—14. — PMID 10618505.
- ↑ Shatwell K. P., Segal A. W. NADPH oxidase. (англ.) // The international journal of biochemistry & cell biology. — 1996. — Vol. 28, no. 11. — P. 1191—1195. — PMID 9022278.
- ↑ Klebanoff S. J. Myeloperoxidase. (англ.) // Proceedings of the Association of American Physicians. — 1999. — Vol. 111, no. 5. — P. 383—389. — PMID 10519157.
- ↑ Meyer K. C. Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good. (англ.) // The Journal of laboratory and clinical medicine. — 2004. — Vol. 144, no. 3. — P. 124—126. — PMID 15478278.
- ↑ Hoffbrand, Pettit, Moss, 2005, p. 118.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 6—10.
- ]
- ↑ Delves, Martin, Burton, Roit, 2006, p. 188.
- ↑ 1 2 Sompayrac, 2008, p. 17.
- ↑ Tipu H. N., Ahmed T. A., Ali S., Ahmed D., Waqar M. A. Chronic granulomatous disease. (англ.) // JPMA. The Journal of the Pakistan Medical Association. — 2008. — Vol. 58, no. 9. — P. 516—518. — PMID 18846805.
- ]
- ↑ Sompayrac, 2008, p. 7.
- ↑ de Almeida S. M., Nogueira M. B., Raboni S. M., Vidal L. R. Laboratorial diagnosis of lymphocytic meningitis. (англ.) // The Brazilian journal of infectious diseases : an official publication of the Brazilian Society of Infectious Diseases. — 2007. — Vol. 11, no. 5. — P. 489—495. — PMID 17962876.
- ↑ Sompayrac, 2008, p. 22.
- ↑ Sompayrac, 2008, p. 63.
- ↑ Apoptosis. Merriam-Webster Online Dictionary. Дата обращения: 19 марта 2009. Архивировано 10 февраля 2012 года.
- ]
- ]
- ]
- ]
- ↑ Sompayrac, 2008, p. 44.
- ↑ Sompayrac, 2008, p. 4.
- ↑ Sompayrac, 2008, p. 24—35.
- ↑ Delves, Martin, Burton, Roit, 2006, pp. 171—184.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 456.
- ↑ Timothy Lee. Antigen Presenting Cells (APC). Immunology for 1st Year Medical Students. Dalhousie University (2004). Дата обращения: 12 ноября 2008. Архивировано 12 января 2008 года.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 161.
- ↑ Sompayrac, 2008, p. 8.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 237—242.
- ]
- ↑ 1 2 Steinman, Ralph M. Dendritic Cells and Immune Tolerance. The Rockefeller University (2004). Дата обращения: 15 февраля 2009. Архивировано из оригинала 11 марта 2009 года.
- ↑ Romagnani S. Immunological tolerance and autoimmunity. (англ.) // Internal and emergency medicine. — 2006. — Vol. 1, no. 3. — P. 187—196. — PMID 17120464.
- ↑ 1 2 Paoletti, Notario, Ricevuti, 1997, p. 427.
- ↑ Sompayrac, 2008, p. 16—17.
- ↑ Sompayrac, 2008, p. 18—19.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 6.
- ↑ Zen K., Parkos C. A. Leukocyte-epithelial interactions. (англ.) // Current opinion in cell biology. — 2003. — Vol. 15, no. 5. — P. 557—564. — PMID 14519390.
- ↑ Sompayrac, 2008, p. 79.
- ↑ Hoffbrand, Pettit, Moss, 2005, p. 117.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 1—6.
- ↑ Sompayrac, 2008, p. 45.
- ↑ Takahashi K., Naito M., Takeya M. Development and heterogeneity of macrophages and their related cells through their differentiation pathways. (англ.) // Pathology international. — 1996. — Vol. 46, no. 7. — P. 473—485. — PMID 8870002.
- ↑ Krombach F., Münzing S., Allmeling A. M., Gerlach J. T., Behr J., Dörger M. Cell size of alveolar macrophages: an interspecies comparison. (англ.) // Environmental health perspectives. — 1997. — Vol. 105 Suppl 5. — P. 1261—1263. — PMID 9400735.
- ↑ 1 2 3 4 Bowers William. Immunology -Chapter Thirteen: Immunoregulation. Microbiology and Immunology On-Line Textbook. USC School of Medicine (2006). Дата обращения: 14 ноября 2008. Архивировано 23 августа 2011 года.
- ↑ Ernst, Stendahl, 2006, p. 8.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 156.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 187.
- ↑ Stvrtinová Viera, Ján Jakubovský and Ivan Hulín. Neutrophils, central cells in acute inflammation // Inflammation and Fever from Pathophysiology: Principles of Disease (англ.). — Computing Centre, Slovak Academy of Sciences: Academic Electronic Press, 1995. — ISBN 80-967366-1-2. Архивировано 31 декабря 2010 года. Архивированная копия. Дата обращения: 19 сентября 2010. Архивировано из оригинала 31 декабря 2010 года.
- ↑ Delves, Martin, Burton, Roit, 2006, p. 4.
- ↑ 1 2 Sompayrac, 2008, p. 18.
- ]
- ↑ Paoletti, Notario, Ricevuti, 1997, p. 62.
- ]
- ]
- ↑ Steinman R. M., Cohn Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. (англ.) // The Journal of experimental medicine. — 1973. — Vol. 137, no. 5. — P. 1142—1162. — PMID 4573839.
- ↑ Steinman Ralph. Dendritic Cells. The Rockefeller University. Дата обращения: 14 ноября 2008. Архивировано 10 февраля 2012 года.
- ]
- ↑ Hoffbrand, Pettit, Moss, 2005, p. 134.
- ]
- ↑ Sompayrac, 2008, pp. 42—46.
- ↑ Steinman Ralph. Dendritic Cells. The Rockefeller University. Дата обращения: 16 ноября 2008. Архивировано 10 февраля 2012 года.
- ]
- ↑ 1 2 Malaviya R., Abraham S. N. Mast cell modulation of immune responses to bacteria. (англ.) // Immunological reviews. — 2001. — Vol. 179. — P. 16—24. — PMID 11292019.
- ↑ Connell I., Agace W., Klemm P., Schembri M., Mărild S., Svanborg C. Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1996. — Vol. 93, no. 18. — P. 9827—9832. — PMID 8790416.
- ↑ Malaviya R., Twesten N. J., Ross E. A., Abraham S. N., Pfeifer J. D. Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 1996. — Vol. 156, no. 4. — P. 1490—1496. — PMID 8568252.
- ↑ Taylor M. L., Metcalfe D. D. Mast cells in allergy and host defense. (англ.) // Allergy and asthma proceedings. — 2001. — Vol. 22, no. 3. — P. 115—119. — PMID 11424870.
- ]
- ↑ Couzinet S., Cejas E., Schittny J., Deplazes P., Weber R., Zimmerli S. Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes. (англ.) // Infection and immunity. — 2000. — Vol. 68, no. 12. — P. 6939—6945. — PMID 11083817.
- ↑ Segal G., Lee W., Arora P. D., McKee M., Downey G., McCulloch C. A. Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts. (англ.) // Journal of cell science. — 2001. — Vol. 114, no. Pt 1. — P. 119—129. — PMID 11112696.
- ↑ Rabinovitch M. Professional and non-professional phagocytes: an introduction. (англ.) // Trends in cell biology. — 1995. — Vol. 5, no. 3. — P. 85—87. — PMID 14732160.
- ↑ 1 2 3 4 5 Todar Kenneth. Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes. 2008. Дата обращения: 10 декабря 2008. Архивировано 10 февраля 2012 года.
- ↑ Alexander J., Satoskar A. R., Russell D. G. Leishmania species: models of intracellular parasitism. (англ.) // Journal of cell science. — 1999. — Vol. 112 Pt 18. — P. 2993—3002. — PMID 10462516.
- ↑ Celli J., Finlay B. B. Bacterial avoidance of phagocytosis. (англ.) // Trends in microbiology. — 2002. — Vol. 10, no. 5. — P. 232—237. — PMID 11973157.
- ]
- ↑ Burns S. M., Hull S. I. Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain. (англ.) // Infection and immunity. — 1999. — Vol. 67, no. 8. — P. 3757—3762. — PMID 10417134.
- ]
- ]
- ↑ ]
- ]
- ]
- ↑ Antoine J. C., Prina E., Lang T., Courret N. The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages. (англ.) // Trends in microbiology. — 1998. — Vol. 6, no. 10. — P. 392—401. — PMID 9807783.
- ↑ Masek Katherine S., Christopher A. Hunter. Eurekah Bioscience Collection: Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila (англ.). — Landes Bioscience[англ.], 2007.
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Paoletti, Notario, Ricevuti, 1997, p. 426—430.
- ]
- ↑ Lee W. L., Downey G. P. Neutrophil activation and acute lung injury. (англ.) // Current opinion in critical care. — 2001. — Vol. 7, no. 1. — P. 1—7. — PMID 11373504.
- ↑ 1 2 Moraes T. J., Zurawska J. H., Downey G. P. Neutrophil granule contents in the pathogenesis of lung injury. (англ.) // Current opinion in hematology. — 2006. — Vol. 13, no. 1. — P. 21—27. — PMID 16319683.
- ]
- ↑ Ricevuti G. Host tissue damage by phagocytes. (англ.) // Annals of the New York Academy of Sciences. — 1997. — Vol. 832. — P. 426—448. — PMID 9704069.
- ]
- ↑ Sompayrac, 2008, p. 1.
- ↑ ]
- ]
- ]
- ↑ Delves, Martin, Burton, Roit, 2006, pp. 251—252.
- ]
Литература
- Delves P. J., Martin S. J., Burton D. R., Roit I. M. Roitt's Essential Immunology. — 11th edition. — Malden, MA: Blackwell Publishing, 2006. — ISBN 1405136030.
- Phagocytosis of Bacteria and Bacterial Pathogenicity / Ernst J. D., Stendahl O. — N. Y.: Cambridge University Press, 2006. — ISBN 0521845696.
- Hoffbrand A. V., Pettit J. E., Moss P. A. H. Essential Haematology. — 4th edition. — L.: Blackwell Science, 2005. — ISBN 0632051531.
- Janeway C. A., Murphy K. M., Travers P., Walport M. Immunobiology. — 5th edition. — N. Y.: Garland Science, 2001. — ISBN 081533642X.
- Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics / Paoletti R., Notario A., Ricevuti G. — N. Y.: The New York Academy of Sciences, 1997. — ISBN 1573311022.
- Phagocyte Function — A guide for research and clinical evaluation / Robinson J. P., Babcock G. F. — N. Y.: Wiley–Liss, 1998. — ISBN 0471123641.
- Sompayrac L. How the Immune System Works. — 3rd edition. — Malden, MA: Blackwell Publishing, 2008. — ISBN 9781405162210.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |