Иммунная система
Имму́нная систе́ма — система биологических структур и процессов организма, обеспечивающая его защиту от
Нарушения в работе иммунной системы приводят к возникновению
Функционирование иммунной системы изучает наука иммунология.
Органы иммунной системы

Иммунную систему образуют органы и анатомические структуры, содержащие лимфоидную ткань и участвующие в образовании клеток, которые осуществляют защитную реакцию организма, создавая
Уровни защиты
Иммунная система обеспечивает защиту организма от инфекций на нескольких уровнях с повышающейся специфичностью. Организм имеет физические барьеры, мешающие проникновению в него вирусов и бактерий. Если патогену удаётся их преодолеть, то он сталкивается со врождённой иммунной системой, которая обеспечивает быстрый, но неспецифический ответ. Врождённая иммунная система имеется у растений и животных[9]. У позвоночных, если патоген преодолевает врождённый иммунный ответ, он сталкивается со следующим рубежом защиты — адаптивной иммунной системой. Адаптивная иммунная система обеспечивает специфический иммунный ответ, направленный против конкретного патогена. После того, как патоген был уничтожен, адаптивная иммунная система «запоминает» его с помощью иммунологической памяти, благодаря которой при повторной встрече с патогеном организм сможет быстро развить специфический иммунный ответ против него[10][11]. В таблице ниже перечислены основные компоненты врождённой и адаптивной иммунной систем.
| Врождённая иммунная система | Адаптивная иммунная система |
|---|---|
| Ответ неспецифичен | Специфический ответ |
| Обеспечивает немедленный иммунный ответ умеренной силы | Обеспечивает отложенный сильный иммунный ответ |
| Имеет клеточную и гуморальную составляющую | Имеет клеточную и гуморальную составляющую |
| Нет иммунологической памяти | После первого столкновения с патогеном появляется иммунологическая память |
| Есть практически у всех форм жизни | Есть только у челюстноротых позвоночных животных |
И врождённая, и адаптивная иммунная системы полагаются на способность организма отличать своё от не-своего. В иммунологии под «своим» понимают
Поверхностные барьеры
Организм защищён от проникновения патогенов несколькими поверхностными барьерами: механическими, химическими и биологическими.
К числу химических барьеров относят антимикробные
В
Врождённая иммунная система
Микроорганизмы и токсины, успешно преодолевшие физические защитные барьеры организма, сталкиваются с противодействием врождённой иммунной системы. Врождённый иммунный ответ, как правило, запускается после распознавания патогенов рецепторами опознавания патогенов, узнающими молекулы, имеющиеся у большинства представителей больших групп патогенов (как липополисахарид у грамотрицательных бактерий)[30]. Врождённый иммунный ответ также запускается при распознавании рецепторами сигналов, исходящих от повреждённых клеток организма или клеток, находящихся в состоянии стресса[англ.]. Врождённая иммунная система неспецифична и обеспечивает ответ на широкий спектр патогенов независимо от их специфических свойств[16][31]. Врождённый иммунитет не обеспечивает долговременную защиту от патогена, тем не менее, эта форма иммунитета доминирует у большинства организмов[9].
Распознавание паттернов

Клетки врождённой иммунной системы распознают молекулы и молекулярные комплексы, продуцируемые микробными клетками, с помощью
Распознавание внеклеточных или заключённых в
Клетки врождённой иммунной системы имеют рецепторы, которые распознают опасные молекулярные паттерны, свидетельствующие об инфекции или повреждении клетки, в
Клеточные компоненты

Важнейшую роль в функционировании врождённого иммунитета играют лейкоциты.
Многие клетки врождённого иммунитета обладают способностью к фагоцитозу, то есть поглощению, патогенных агентов. Фагоциты «патрулируют» организм в поисках патогенных клеток или же направленно мигрируют к очагу инфекции по направлению, указываемому
Крупнейшие группы фагоцитов — нейтрофилы и макрофаги[44]. Нейтрофилы в норме циркулируют по кровотоку и являются самой многочисленной группой фагоцитов, составляя от 50 % до 60 % всех лейкоцитов в крови[45]. В ходе острой фазы воспаления нейтрофилы мигрируют к очагу воспаления посредством хемотаксиса и, как правило, первыми из иммунных клеток прибывают в очаг инфекции. Макрофаги, в отличие от нейтрофилов, находятся в тканях и не циркулируют по кровеносным сосудам. Макрофаги секретируют разнообразные вещества, такие как ферменты, белки системы комплемента и цитокины, поглощают остатки погибших клеток организма, а также выступают в роли антигенпрезентирующих клеток, активирующих адаптивный иммунный ответ[46].
В тканях, контактирующих со внешней средой, находятся фагоциты, относящиеся к числу дендритных клеток. Дендритные клетки обнаруживаются в коже, эпителии
Лейкоциты, в цитоплазме которых содержатся гранулы, получили общее название гранулоциты. К гранулоцитам относятся нейтрофилы, базофилы и эозинофилы. В
Врождённые лимфоидные клетки являются производными общей клетки-предшественницы иммунных клеток. Они не имеют
Воспаление
Воспаление является одной из первых реакций иммунной системы на развивающуюся инфекцию
Система комплемента

Система комплемента представляет собой биохимический каскад, направленный на нарушение целостности чужеродных клеток. В состав системы комплемента входит более 20 белков, которые дополняют («комплементируют») действие антител по уничтожению патогенов[58][59]. Система комплемента — важнейший гуморальный компонент врождённого иммунитета. Система комплемента есть не только у позвоночных, но и у беспозвоночных животных и даже растений[39].
У человека компоненты системы комплемента связываются либо с антителами, уже прикрепившимися к микробным клеткам, либо с
Адаптивная иммунная система
В ходе эволюции адаптивная иммунная система появилась у челюстноротых животных. Адаптивный иммунитет обеспечивает сильный специфический ответ, а также формирование иммунологической памяти. Адаптивный иммунный ответ специфичен по отношению к определённому антигену, распознавание которого клетками адаптивного иммунитета происходит в ходе процесса презентации антигена. После уничтожения патогена сохраняются клетки адаптивного иммунитета, которые хранят сведения о его антигенах и обеспечивают иммунологическую память. Благодаря ей при вторичном проникновении патогена на него развивается быстрый специфический иммунный ответ[62].
Распознавание антигена
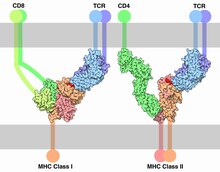
Клетки адаптивного иммунитета представлены специфической группой лейкоцитов — лимфоцитами, которые подразделяют на T-лимфоциты (T-клетки) и B-лимфоциты (B-клетки). Лимфоциты образуются от гемоцитобластов в костном мозге, и далее T-клетки созревают в тимусе, а B-клетки созревают в костном мозге. T-клетки обеспечивают клеточный адаптивный иммунный ответ, а B-клетки — гуморальный адаптивный иммунный ответ. T- и B-клетки несут на своей поверхности рецепторы (T- и B-клеточные рецепторы соответственно), распознающие антигены. Как правило, T-клетки не способны распознавать антигены в исходной форме; они распознают только
Клеточный адаптивный иммунный ответ

Среди T-клеток выделяют три основные популяции: T-киллеры, T-хелперы и регуляторные T-клетки. T-киллеры уничтожают инфицированные и повреждённые клетки
T-хелперы регулируют адаптивный и приобретённый иммунные ответы. T-хелперы лишены цитотоксической активности, они не уничтожают ни клетки патогена, ни заражённые клетки
Регуляторные T-клетки, ранее известные как супрессорные T-клетки, подавляют функционирование и пролиферацию эффекторных T-клеток, предотвращая развитие аутоиммунных заболеваний[70], и по происхождению родственны T-хелперам. Как и T-хелперы, регуляторные T-клетки экспрессируют корецептор CD4[71]. γδ-T клетки экспрессируют альтернативную форму TCR, отличающуюся от таковой у CD4+ и CD8+ T-клеток, и совмещают свойства T-хелперов, T-киллеров и NK-клеток[72].
Гуморальный адаптивный иммунный ответ
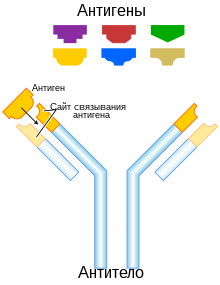
B-клетки распознают антигены посредством B-клеточных рецепторов, которые представляют собой антитела, заякоренные на поверхности B-клеток
Физиологическая регуляция

Иммунная система тесно взаимодействует с другими системами органов, в частности, эндокринной[76][77] и нервной[78][79][80]. Иммунная система также играет важную роль в восстановлении целостности тканей и регенерации.
Гормоны
Гормоны из группы глюкокортикоидов являются важнейшими регуляторами иммунной системы, так как повышают экспрессию противовоспалительных белков (таких как липокортин I[англ.], p11[англ.], SLPI и MAPK-фосфатазы[89]) и понижают выработку провоспалительных белков. Благодаря выраженному противовоспалительному действию глюкокортикоиды используются в терапии аутоиммунных заболеваний, аллергии, сепсиса[90]. Глюкокортикоиды также задействованы в регуляции развития T-клеток[91].
Когда T-клетка встречается с патогеном, она выставляет наружу рецептор витамина D[англ.]. Благодаря ему T-клетка взаимодействует с активной формой витамина D — стероидным гормоном кальцитриолом. Но этим связь T-клеток с витамином D не ограничивается. T-клетки экспрессируют ген CYP27B1[англ.], кодируемый которым фермент превращает производное витамина D кальцидиол в кальцитриол. T-клетки могут выполнять свои защитные функции только после связывания с кальцитриолом. Ген CYP27B1 экспрессируется и некоторыми другими клетками, которые также способны образовывать кальцитриол из кальцидиола: дендритными клетками, макрофагами, а также кератиноцитами[92][93].
Предполагается, что прогрессирующее снижение уровня гормонов с возрастом может быть связано с ослабленным иммунитетом у пожилых людей[94]. Кроме того, иммунная система также влияет на эндокринную, в частности, на тиреоидные гормоны[95]. Возрастное снижение иммунитета коррелирует с понижающимся уровнем витамина D у людей преклонного возраста[96].
Сон и отдых
У людей, страдающих от недостатка сна, может наблюдаться сниженный по сравнению с обычными людьми иммунный ответ и пониженное образование антител в ответ на инфекцию. Кроме того, нарушения циклов чередования светлого и тёмного времени суток нарушают работу белка
Помимо отрицательного эффекта нехватки сна на работу иммунной системы, сон и циркадные ритмы оказывают сильное регулирующее воздействие и на врождённый, и на приобретённый иммунитет. Во время медленноволнового сна происходит резкий провал в уровне кортизола, адреналина и норадреналина, из-за чего возрастает концентрация лептина, соматотропина и пролактина. Эти гормоны связаны с образованием провоспалительных цитокинов IL-1, IL-12[англ.], TNFα и INFγ, которые активируют иммунные клетки, способствуют их пролиферации и дифференцировке. Именно во время медленноволнового сна по ходу медленно развивающегося адаптивного иммунного ответа достигает пика численность недифференцированных или слабо дифференцированных наивных T-клеток[англ.] и T-клеток памяти. Кроме того, гормоны, активно продуцирующиеся во время медленного сна (лептин, соматотропин и пролактин), поддерживают взаимодействие антигенпрезентирующих клеток и T-клеток, увеличивают пролиферацию T-хелперов и миграцию наивных T-клеток в лимфоузлы. Считается, что эти же гормоны способствуют формированию долговременной иммунологической памяти, активируя ответ T-хелперов[102].
Во время бодрствования, напротив, пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины. Существуют две гипотезы относительно того, почему во время сна активируются провоспалительные сигналы в иммунной системе. Во-первых, если бы активный воспалительный ответ происходил во время бодрствования, он бы вызывал серьёзные физические и когнитивные нарушения. Во-вторых, протеканию воспаления во сне может способствовать мелатонин. Во время воспаления образуется огромное количество свободных радикалов (окислительный стресс), и мелатонин может противостоять их образованию во время сна[102][103].
Питание
Переедание связано с такими заболеваниями, как
Заживление ран и регенерация
Иммунная система, в особенности её врождённая составляющая, играет важнейшую роль в восстановлении тканей после повреждения.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности[114].
Иммунодефицит
Иммунодефицит возникает при недостаточной эффективности работы иммунной системы, когда один или более её компонентов не функционируют. Активность иммунной системы после 50 лет постепенно снижается, этот процесс называют .
Аутоиммунные заболевания
Аутоиммунные заболевания связаны с повышенной гиперактивностью иммунной системы, которая начинает атаковать белки самого организма. Таким образом, при аутоиммунных заболеваниях нарушается механизм распознавания своего и чужого. В норме T-клетки, способные распознавать собственные белки организма, уничтожаются с помощью специальных механизмов
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе. Гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток. О гиперчувствительности II типа говорят, когда в организме присутствуют антитела, распознающие его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и M (IgM). Иммунные комплексы, представляющие собой скопления антигенов, белков комплемента, IgG и IgM, запускают реакции гиперчувствительности III типа. Гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2—3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги[121].
Медицинские манипуляции
Иммуносупрессия
Препараты-иммуносупрессоры (иммунодепрессанты) используются при лечении аутоиммунных заболеваний, избыточных воспалений, а также для предотвращения отторжения
Вакцинация
Активный иммунитет может быть создан искусственно за счёт вакцинации. Основной принцип вакцинации, или иммунизации, заключается во введении в организм антигена некоторого патогена с целью развить против него специфический иммунитет без перенесения болезни
Предсказание иммуногенности
Организм может развивать нейтрализующий иммунный ответ после введения препаратов, представляющих собой крупные пептиды и белки массой более 500
Иммунологическая толерантность
Под иммунологической толерантностью понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ. Специфическая неотвечаемость на определённые антигены необходима на некоторых стадиях онтогенеза, а также для нормального протекания беременности у млекопитающих (иммунологическая толерантность при беременности). Развитие толерантности к некоторым антигенам происходит на ранних этапах развития организма. Кроме того, толерантность можно искусственно индуцировать на ранних этапах онтогенеза, в частности, за счёт введения антигена в новорождённый организм с не до конца сформированной иммунной системой. Клеточные и молекулярные механизмы толерантности, сформированной в начале развития организма и во взрослом возрасте, нередко отличаются. Так, у новорождённых мышей макрофаги малочисленны, поэтому иммунная система не может развить эффективный ответ. В развитии иммунологической толерантности важную роль играют регуляторные T-клетки, подавляющие T-хелперы[131].
Иммунология опухолей
Помимо борьбы с патогенами, важная роль иммунной системы заключается в выявлении и уничтожении злокачественных клеток. Клетки опухолей, претерпевшие злокачественную трансформацию, часто экспрессируют поверхностные антигены, отсутствующие у нормальных клеток. Иммунная система воспринимает эти антигены как чужеродные, поэтому они запускают иммунный ответ против злокачественных клеток. Опухолевые антигены могут иметь разное происхождение.
Противоопухолевый иммунный ответ заключается преимущественно в уничтожении опухолевых клеток T-киллерами, иногда при участии T-хелперов[136][139]. Опухолевые антигены презентируются в комплексе с MHC-I подобно вирусным белкам, благодаря чему T-киллеры могут распознать злокачественные клетки[140]. NK-клетки тоже уничтожают опухолевые клетки, особенно если они экспрессируют MHC-I на низком уровне по сравнению с нормой, что происходит с опухолевыми клетками довольно часто[141]. В некоторых случаях в организме образуются антитела к опухолевым антигенам, и злокачественные клетки уничтожаются системой комплемента[137].
Некоторым опухолям удаётся избежать иммунного ответа.
Макрофаги могут способствовать росту опухоли из-за цитокинов, которые они используют для привлечения других макрофагов, например, TNFα
Эволюция
Многокомпонентная адаптивная иммунная система в ходе эволюции появилась, вероятнее всего, у челюстноротых позвоночных, поскольку у беспозвоночных нет ни лимфоцитов, ни антител.
Некоторые компоненты врождённого иммунитета, такие как рецепторы распознавания паттернов, есть практически у всех организмов. Антимикробные пептиды есть у растений и животных, причём у беспозвоночных именно антимикробные пептиды являются главной формой системного иммунитета[1]. У большинства беспозвоночных животных также есть система комплемента и фагоциты. Главную роль в противовирусной защите от вирусов играют ферменты рибонуклеазы и механизм РНК-интерференции, которые консервативны практически у всех эукариот[152].
В отличие от животных, растения не имеют клеток, способных к фагоцитозу, однако растения всё же имеют иммунную систему, работа которой построена на передаче химических сигналов по всему растительному организму[153]. Отдельные клетки растений также могут реагировать на PAMPs[154]. При заражении участка растительной ткани формируется локальная реакция гиперчувствительности, из-за которой клетки, располагающиеся в зоне поражения, претерпевают апоптоз и становятся неспособны передавать патогены другим клеткам. Организм растения может приобрести резистентность к патогену целиком благодаря защитной реакции, известной как системная приобретённая резистентность[англ.][153]. Важную роль в системном ответе растений на вирусную инфекцию играет РНК-интерференция, блокирующая репликацию вирусов[155].
Хотя классические молекулы адаптивной иммунной системы, такие как
Противодействие патогенов
Успех любого патогена зависит от того, насколько успешно он может преодолевать барьеры иммунной системы организма. Поэтому патогены развили несколько механизмов, которые помогают им уклоняться от действия иммунной системы или приводят к её разрушению[157]. Бактерии часто преодолевают защитные барьеры организма, выделяя ферменты, которые их разрушают, например, с помощью систем секреции II типа[158]. Системы секреции III типа обеспечивают связь клетки бактерии с клеткой организма-хозяина посредством полых трубок, благодаря чему белки патогена непосредственно доставляются в клетки организма-хозяина. Часто эти белки предназначены для выключения защитных механизмов хозяина[159].
Некоторые патогены, например, внутриклеточные, избегают иммунного ответа, «прячась» внутри клеток хозяина. Такие патогены большую часть своего жизненного цикла проводят внутри клеток хозяина, где они защищены от действия иммунных клеток, антител и системы комплемента. К числу внутриклеточных патогенов относятся вирусы, некоторые бактерии (например,
Механизмы избегания адаптивного иммунного ответа устроены более сложно. Простейшим из них является
История изучения

Первые известные записи о существовании иммунитета датируются 430 годом
В XVIII веке
Иммунология бурно развивалась в конце XIX века. В то время интенсивно изучались клеточные и гуморальные основы иммунитета
В 1950-х годах
Примечания
- ↑ ]
- ]
- ↑ Галактионов, 2004, с. 164.
- ]
- ]
- ]
- ]
- ↑ Бурместер, Пецутто, 2014, с. 14.
- ↑ ]
- ]
- ]
- ↑ Smith A. D. (Ed). Oxford dictionary of biochemistry and molecular biology (англ.). — Oxford University Press, 2000. — P. 592. — ISBN 0-19-854768-4.
- ]
- ]
- ]
- ↑ 1 2 3 4 5 6 7 8 Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walters, Peter. Molecular Biology of the Cell. — Fourth. — New York and London: Garland Science[англ.], 2002. — ISBN 978-0-8153-3218-3. Архивировано 18 сентября 2009 года.
- ↑ Галактионов, 2004, с. 327—328.
- ]
- ]
- ↑ Moreau J. M., Girgis D. O., Hume E. B., Dajcs J. J., Austin M. S., O'Callaghan R. J. Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus. (англ.) // Investigative Ophthalmology & Visual Science. — 2001. — September (vol. 42, no. 10). — P. 2347—2354. — PMID 11527949.
- ]
- ]
- ]
- ]
- ↑ Gorbach S. L. Lactic acid bacteria and human health. (англ.) // Annals Of Medicine. — 1990. — February (vol. 22, no. 1). — P. 37—41. — PMID 2109988.
- ↑ Hill L. V., Embil J. A. Vaginitis: current microbiologic and clinical concepts. (англ.) // CMAJ : Canadian Medical Association Journal = Journal De L'Association Medicale Canadienne. — 1986. — 15 February (vol. 134, no. 4). — P. 321—331. — PMID 3510698.
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ 1 2 3 Murphy, Weaver, 2017, p. 37—77.
- ]
- ]
- ]
- ]
- ↑ Zen K., Parkos C. A. Leukocyte-epithelial interactions. (англ.) // Current opinion in cell biology. — 2003. — Vol. 15, no. 5. — P. 557—564. — PMID 14519390.
- ↑ 1 2 Stvrtinová, Viera; Jakubovský, Ján; Hulín, Ivan. Inflammation and Fever from Pathophysiology: Principles of Disease (англ.). — Computing Centre, Slovak Academy of Sciences: Academic Electronic Press, 1995. — ISBN 80-967366-1-2. Архивировано 11 июля 2001 года.
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Le Y., Zhou Y., Iribarren P., Wang J. Chemokines and chemokine receptors: their manifold roles in homeostasis and disease. (англ.) // Cellular & Molecular Immunology. — 2004. — April (vol. 1, no. 2). — P. 95—104. — PMID 16212895.
- ]
- ↑ ]
- ]
- ]
- ]
- ]
- ]
- ↑ Murphy, Weaver, 2017, p. 139—173.
- ]
- ↑ ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Murphy, Weaver, 2017, p. 399—445.
- ]
- ]
- ]
- ]
- ]
- ↑ Wira, CR; Crane-Godreau M; Grant K. Endocrine regulation of the mucosal immune system in the female reproductive tract // Mucosal Immunology / Ogra P. L., Mestecky J., Lamm M. E., Strober W., McGhee J. R., Bienenstock J.. — San Francisco: Elsevier, 2004. — ISBN 0-12-491543-4.
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Sleep's Effects On Your Immune System Revealed In New Body Clock Study (8 ноября 2013). Дата обращения: 30 марта 2020. Архивировано 17 ноября 2013 года.
- ↑ ]
- ↑ Can Better Sleep Mean Catching fewer Colds? Дата обращения: 28 апреля 2014. Архивировано из оригинала 9 мая 2014 года.
- ↑ R. M. Suskind, C. L. Lachney, J. N. Udall, Jr. Malnutrition and the Immune Response, in: Dairy products in human health and nutrition, M. Serrano-Ríos, ed. — CRC Press, 1994. — P. 285–300.
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Галактионов, 2004, с. 364, 375, 380.
- ]
- ↑ ]
- ]
- ↑ Copeland K. F., Heeney J. L. T helper cell activation and human retroviral pathogenesis. (англ.) // Microbiological Reviews. — 1996. — December (vol. 60, no. 4). — P. 722—742. — PMID 8987361.
- ]
- ↑ Галактионов, 2004, с. 376—377.
- ↑ Ghaffar, Abdul Immunology – Chapter Seventeen: Hypersensitivity States. Microbiology and Immunology On-line. University of South Carolina School of Medicine (2006). Дата обращения: 29 мая 2016. Архивировано 18 мая 2016 года.
- ↑ 1 2 Murphy, Weaver, 2017, p. 701—748.
- ↑ ]
- ]
- ]
- ↑ Death and DALY estimates for 2002 by cause for WHO Member States. World Health Organization. Retrieved on 1 January 2007. Дата обращения: 30 марта 2020. Архивировано 2 мая 2008 года.
- ]
- ]
- ]
- ↑ Flower D. R., Doytchinova I. A. Immunoinformatics and the prediction of immunogenicity. (англ.) // Applied Bioinformatics. — 2002. — Vol. 1, no. 4. — P. 167—176. — PMID 15130835.
- ↑ Галактионов, 2004, с. 316—321.
- ↑ ]
- ]
- ]
- ]
- ↑ ]
- ↑ ]
- ]
- ]
- ↑ ]
- ]
- ↑ ]
- ↑ ]
- ]
- ]
- ↑ Bickle T. A., Krüger D. H. Biology of DNA restriction. (англ.) // Microbiological Reviews. — 1993. — June (vol. 57, no. 2). — P. 434—450. — PMID 8336674.
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ 1 2 Schneider, David Innate Immunity – Lecture 4: Plant immune responses. Stanford University Department of Microbiology and Immunology. Дата обращения: 1 января 2007. Архивировано 6 января 2017 года.
- ]
- ]
- ]
- ]
- ]
- ]
- ↑ Finlay B. B., Falkow S. Common themes in microbial pathogenicity revisited. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 1997. — June (vol. 61, no. 2). — P. 136—169. — PMID 9184008.
- ]
- ]
- ]
- ]
- ]
- ↑ Retief F. P., Cilliers L. The epidemic of Athens, 430-426 BC. (англ.) // South African Medical Journal = Suid-Afrikaanse Tydskrif Vir Geneeskunde. — 1998. — January (vol. 88, no. 1). — P. 50—53. — PMID 9539938.
- ]
- ↑ Silverstein, Arthur M.[англ.]. A History of Immunology. — Academic Press, 1989. — С. 6—7. — ISBN 978-0-08-092583-7.
- ]
- ]
- ↑ The Nobel Prize in Physiology or Medicine 1905. Nobelprize.org. Accessed 8 January 2009. Дата обращения: 30 марта 2020. Архивировано 10 декабря 2006 года.
- ↑ Major Walter Reed, Medical Corps, U.S. Army. Walter Reed Army Medical Center. Accessed 8 January 2007. Дата обращения: 30 марта 2020. Архивировано из оригинала 23 октября 2007 года.
- ↑ Metchnikoff, Elie[англ.]; Translated by F.G. Binnie. Immunity in Infective Diseases. — Cambridge University Press, 1905.. — «history of humoral immunity.».
- ↑ The Nobel Prize in Physiology or Medicine 1908. Nobelprize.org Accessed 8 January 2007. Дата обращения: 30 марта 2020. Архивировано 19 февраля 2007 года.
- ↑ Burnet F. M. The Clonal Selection Theory of Acquired Immunity (англ.). — Cambridge: Cambridge University Press, 1959.
- ↑ Burnet F. M. Cellular Immunology: Self and Notself. — Cambridge: Cambridge University Press, 1969.
- ]
Литература
- Бурместер Г.-Р., Пецутто А. Наглядная иммунология. — М.: БИНОМ. Лаборатория знаний, 2014. — 320 с. — ISBN 978-5-9963-1731-8.
- Галактионов В. Г. Иммунология. — М.: Издат. центр «Академия», 2004. — 528 с. — ISBN 5-7695-1260-1.
- Kenneth Murphy, Casey Weaver. Janeway's Immunobiology. — Garland Science, 2017. — ISBN 978-0-8153-4505-3.
Ссылки
- Immune System Архивная копия от 2 мая 2019 на University of Hartford(англ.)
- Microbiology and Immunology from the University of South Carolina(англ.)
- Иммунная система : Какие агенты внутри нас защищают организм от угроз : гид / Научн. консульт. Николай Никитин (докт. мед. наук, проф. каф. вирусологии биофака МГУ). — Постнаука. — 2023.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |